Аминокислоты играют жизненно важную роль в метаболизме. Им необходимо расщеплять еду и синтезировать белок. Человеческий организм не может расти и развиваться при отсутствии аминокислот. Важнейшие аминокислоты, такие как лизин, лейцин и триптофан, не вырабатываются кровью и поставляются в организм с пищей, например орехами, злаками, овощами, молоком, сыром, яйцами и некоторыми сортами мяса. Однако не столь важные аминокислоты, такие как пролин, глутаминовая кислота и глицин, вырабатываются организмом при расщеплении основных аминокислот. Тем не менее, организм маленьких детей обычно не способен синтезировать неосновные аминокислоты, так как он не достаточно для этого развит. Поэтому дети зачастую страдают от нехватки аминокислот, что препятствует их росту и развитию.
Анализ на аминокислоты в плазме крови – это анализ, который проводится для определения уровня аминокислот в крови. Он дает ясную картину способности детского организма расщеплять белки. Если определенная кислота обнаруживается в избытке, это говорит о том, что организм не может усваивать эту кислоту. Уровень аминокислот обычно низок, когда ребенок страдает от определенного заболевания или недавно имел повышенную температуру тела. Низкий уровень аминокислот может также указывать на недостаток питательных веществ. Исследование даст информацию, которая поможет в дальнейшем лечении.
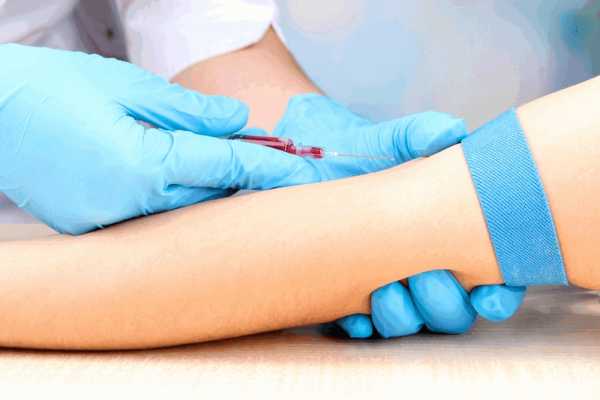
Для анализа аминокислот в крови ребенку нельзя есть за 4 часа до исследования. Возможно, что во время теста ваш ребенок будет плакать из-за легкой боли или из страха перед незнакомыми людьми и проводимой процедурой. Если ребенок достаточно взрослый, чтобы понимать процедуру, будет полезно подготовить его к тесту морально.
Вы, как родители, должны быть расслаблены, так как волнение, которое вы испытываете, может передаться и малышу.
В случае с маленькими детьми кровь из вены взять сложно, так как они не могу сидеть спокойно. Поэтому анализ аминокислот проводится по образцу крови, взятому из пятки. Вначале пятка тщательно очищается с помощью бактерицидного препарата. Затем кожа прокалывается с помощью ланцета или острой иглы. Кровь собирается на стеклянную пластинку, тестовую полоску или в маленькую стеклянную пробирку, называемую пипеткой. После этого на место прокола может накладываться повязка, чтобы остановить возможное кровотечение. Затем кровь исследуется в лаборатории посредством процесса, называемого хроматографией.
Смотрите также:
Анализ мочи на аминокислоты
doctor-test.ru
Основу протеинового белка составляют аминокислоты — органические соединения в организме человека. Для выявления проблем с функционированием печени и почек, необходимо провести анализ крови на аминокислоты, так как нарушенный аминокислотный обмен приводит к заболеваниям этих органов. Степень усвоения белка в крови и метаболический дисбаланс устанавливается путем проведения анализа 20 аминокислот.
Следующее сочетание симптомов у детей и взрослых, являются признаками нарушения аминокислотного обмена:
Некоторые аминокислоты синтезируются в организме, а некоторые поставляются с потреблением пищи.
Аланин. С помощью аминокислоты аланина центральная нервная система и головной мозг получают энергию. Аланин участвует в метаболизме органических кислот и сахаров, а также вырабатывает антитела в крови, что способствует укреплению иммунитета. Кроме того, из данного типа аминокислот может вырабатываться глюкоза, то есть регуляция уровня сахара в крови проходит с участием аланина.
Аргинин. Это заменимая аминокислота, с помощью которой из организма человека выводится конечный азот.
Аспаргиновая кислота. Содержится в белковом составе. При увеличении ее концентрации в моче, возникает дикарбоксильная аминоацидурия.
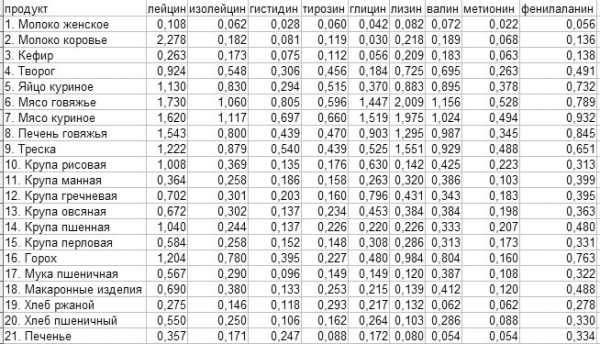 Таблица аминокислот в продуктах питания
Таблица аминокислот в продуктах питанияГлутаминовая кислота. Глутаминовая аминокислота выполняет в организме множество функций, среди которых участие в обмене белками и углеводами, стимулирование окислительных процессов, повышение устойчивости организма к гипоксии (кислородное голодание), нормализация обмена веществ. Она способствует выведению токсинов и аммиака из организма.
Глицин. В ЦНС протекают процессы возбуждения и торможения. За нормальное функционирование этих процессов отвечает глицин. Он способствует улучшению умственной работоспособности, а также помогает человеку справиться со стрессом.
Треонин. Треонин способствует стимуляции иммунной системы, улучшает энергообсеспечение. К его функциям относится обезвреживание аммиака.
Метионин. Дезинтоксикация ксенобиотиков протекает с помощью метионина. Гормоны, витамины, белки и ферменты в крови активируются благодаря метионину.
Тирозин. Синтез тирозина может протекать в организме. Он является незаменимой аминокислотой. Повышенное содержание тирозина в крови говорит о возможном сепсисе.
Валин. Синтез роста тканей тела невозможен без валина. Он способствует стимуляции координации, улучшает умственную деятельность и активность. Поврежденные ткани восстанавливаются благодаря валину, также с его участием протекает метаболизм в мышцах.
Фенилаланин. Аминокислота фенилаланина способствует улучшению памяти и способности к обучению. Фенилаланин способен уменьшить боль и подавить аппетит. Он также оказывает влияние на настроение.
Лейцин и изолейцин. Лейцин и изолейцин это аминоксилоты, действуя вместе, служат источниками энергии. Еще одной их функцией является защита мышечных тканей. На психическую устойчивость и физическую выносливость влияет изолицейн. Без него невозможна выработка гемоглобина в крови. Он также осуществляет регуляцию уровня сахара в крови и занимает важное место при проблемах с психикой и физических нагрузках. Лейцин отвечает за восстановление кожи, мышц, костей, так как вырабатывает гормон роста.
Далее приведен список болезней и соответствующие характеристики из расшифровки анализа крови на аминокислоты:
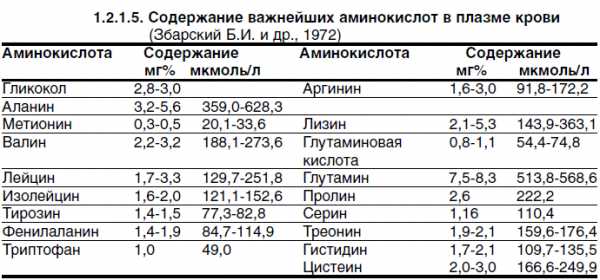 Таблица нормы аминокислот
Таблица нормы аминокислотОтклонения от нормы анализа крови на аминокислоты являются поводом для беспокойства.
По мнению врачей, следующим группам людей необходимо делать анализ крови на аминокислоты (32 показателя):
Анализ крови на аминокислоты можно сдать во многих клиниках. Перед сдачей аминокислотного анализа нельзя принимать пищу в течение 4 часов. Забор крови у грудничка проводится из пятки. Возможно образование гематомы. Срок выполнения анализа составляет около 16 дней.
Анализ крови на аминокислоты для детей имеет большое значение, так как помогает своевременно выявить проблемы со здоровьем и приступить к лечению.
Анализ крови на аминокислоты и ацилкарнитины проводится с целью выявления наследственных болезней. Чем раньше обнаружится патология, тем больше вероятность предотвращения тяжелых заболеваний.
sostavkrovi.ru
Количественное определение свободных аминных групп аминокислот, полипептидов и белков широко применяется для исследования ферментативного распада белковых веществ и их гидролиза другими способами (см. стр. 34). Помимо ценных сведений о строении белковой молекулы и переваривания белков, определение аминоазота дает возможность судить о содержании свободных аминокислот и пептидов в крови, моче и других жидкостях и тканях организма. [c.184]
Обычные аминокислоты Обычные аминокисло- Катионит Двойная колонка Цитрат натрия Различные Нингидрин Нингидрин Зависимость содержания свободных аминокислот в моче от возраста человека Определение аминокислот в крови 10 11 [c.38]
Таким образом, сама жизнь организма зависит от способности крови регулировать pH в определенных пределах. А это достигается содержанием в крови ацетатных, фосфорных и карбонатных буферных систем, а также систем с таким же действием из аминокислот и белков. [c.180]
Проведены исследования по определению содержания аминокислот в сыворотке крови больных инфарктом миокарда и другими сосудистыми заболеваниями [63]. Найдены значительные изменения в содержании некоторых аминокислот в сыворотке крови больных с поражениями миокарда. [c.10]
Параллельно с указанными изменениями в углеводном обмене отмечаются определенные изменения и в азотистом (белковом) обмене. Так, у животных с удаленными надпочечниками отмечается не только понижение содержания сахара в крови, но и уменьшение выделения азота с мочой. Наоборот, введение кортикостероидных гормонов ведет не только к повышению уровня сахара в крови, но и к увеличению содержания азота в моче. Параллелизм между этими двумя явлениями позволил сформулировать экспериментально подтвержденное предположение о том, что кортикостероидные гормоны стимулируют образование сахара (глюкозы) из продуктов распада белков (аминокислот). По-видимому, функция гормонов коры надпочечников в белковом обмене заключается в задержке синтеза и в усилении распада белков, в стимуляции синтеза углеводов из аминокислот, образовавшихся при этом усиленном распаде белков, или из аминокислот, не использованных в результате заторможенного белкового синтеза. [c.195]
В цитоплазме клеток разных органов есть белковые рецепторы, способные избирательно присоединять глюкокортикоиды. После связывания с рецептором гормон перемещается внутрь клетки, где в составе транспортных комплексов с белками переносится в ядро и взаимодействует с хроматином, изменяя скорость транскрипции определенных генов, влияя тем самым на скорость синтеза соответствующих белков. Таким образом, глюкокортикоиды влияют на генетический аппарат клеток. Глюкокортикоиды преимущественно воздействуют на обмен углеводов усиливают синтез гликогенсинтетазы, вследствие чего ускоряется синтез гликогена. Они также мобилизуют триацилглицерины из жировой ткани и подавляют синтез антител, уменьшая чувствительность организма к чужеродным веществам и предотвращая развитие аллергических реакций и воспалительных процессов. В результате действия глюкокортикоидов в крови повышается содержание глюкозы, аминокислот, жирных кислот, глицерина, кетоновых тел. [c.303]
К 1—2 мл крови добавляют равный объем 0,04 н. раствора СНзСООН, нагревают на кипящей водяной бане 2—3 мин, охлаждают я осадок белка отделяют центрифугированием. Центрифугат сливают и упаривают досуха. Сухой остаток растворяют в 0,1—0,2 мл смеси НСООН—СНзСООН—Н2О (7 5 13), нерастворившийся осадок отбрасывают. На хроматограмму наносят 0,01—0,02 мл полученного раствора и стандартные смеси аминокислот и хроматографируют в бута-нолуксусной смеси. После разгонки хроматограммы обрабатывают нингидрином, идентифицируют аминокислоты и проводят их количественное определение. Содержание аминокислот в сыворотке крови выражают в микромолях, миллиграмм-процентах или процентах к небелковому азоту. [c.195]
Клетки, выращиваемые в тканевой культуре, могут утратить способность к ряду обменных превращений. Вполне вероятно, однако, что лишь некоторые виды клеток животного организма осуществляют такие реакции, как синтез глутамина или превращение фенилаланина в тирозин. По-видимому, глутамин синтезируется в определенных клетках и переносится к другим током крови. Интересно отметить, что минимальная концентрация глутамина, необходимая для оптимального роста тканевых культур, значительно выше, чем необходимые. концентрации других аминокислот. Количество глутамина в крови также значительно превосходит содержание в ней других аминокислот (табл. 3). [c.132]
Буферные растворы играют важную роль в биологии и медицине. Так, водные растворы живого организма характеризуются определенными величинами pH. Например, pH крови колеблется в пределах 7—7,9 со средней величиной 7,4. Если pH выходит за эти пределы, то кровь теряет способность переносить кислород. Сама жизнь организма зависит от способности крови регулировать pH в весьма узких пределах. А это достигается содержанием в крови ацетатных, фосфорных и карбонатных буферных систем, а также систем с таким же действием из аминокислот и белков. [c.141]
Особенно плодотворно изотопы применяются для исследования обмена веществ. Изучаемое вещество метят (поэтому метод получил название метод меченых атомов ), вводя в него радиоактивный изотоп меченое вещество вводят в организм. После его ассимиляции исследуют присутствие меченых атомов в различных химических фракциях в организме. Концентрация вводимого в организм радиоактивного изотопа должна быть небольшой, чтобы не нарушался обмен веществ, но такой, при которой, несмотря на разведение, изотоп мог бы быть обнаружен во всех выделяемых фракциях. Например, применение СОг с меченым углеродом позволило показать широкое участие двуокиси углерода в реакциях метаболизма бактерий и тканей живого организма, расширить наши представления о механизме фотосинтеза. Изотопный метод применяется в биохимии для количественного определения аминокислот в гидролизатах белков, содержания калия, натрия и других элементов в крови, для определения общего количества воды в живом организме, объема эритроцитов и плазмы в кровотоке и т. д. [c.12]
Аминокислоты, необходимые для синтеза белков, доставляются к тканям кровью. Этим, однако, не исчерпывается участие крови в синтезе белков в организме. Большое значение в процессах обмена белков тканей имеют белки плазмы крови, альбумины и глобулины. У человека и животных постоянно н интенсивно происходит взаимопревращение белков плазмы крови и белков тканей. Это взаимопревращение приводит к тому, что между количеством белков (плазмы) в крови и содержанием белков в тканях устанавливается определенное равновесие. При голодании, кровопотерях (белковое голодание) это равновесие нарушается. Нормальное количественное соотношение между белками плазмы крови и белками тканей в этих случаях в организме легко восстанавливается при введении в кровь извне кровяной плазмы, или гетерогенной кровяной сыворотки. Подобное введение белков в кровь носит название парентерального белкового питания. [c.432]
Функциональный резерв печени в отношении обычного уровня процессов дезаминирования и синтеза мочевины настолько велик, что они выполняются в полном объеме даже при сохранении всего лишь 20—10% неповрежденной паренхимы (А. Фишер, 1961 Wappler Справочник по клиническим и функциональным исследованиям, 1966). Поэтому как количественное определение содержания аминокислот в крови химическим путем, так и качественное их определение в крови и моче с помощью метода хроматографии позволяет установить изменения лишь при далеко зашедших поражениях паренхимы. В то же время, по данным зарубежных авторов, нагрузки такими соединениями, как гликокол и п-оксифенил-пировиноградная кислота (тестацид), часто позволяют открыть наличие начальных гепатоцеллюлярных поражений (Felix, [c.191]
Определение муравьиной кислоты как в крови, так и в моче является большим подспорьем при дифференциальной диагностике отравления. Нужно иметь, однако, в виду, что муравьиная кислота может образовываться в организме в норме, по-видимому, при гидролитическом дезаминировании аминокислот. Содержание муравьиной кислоты в крови в норме составляет у человека 0,4 мг% (Stepp, Zumbus h, 1920), содержание муравьиной кислоты в суточном количестве мочи в норме колеблется [c.147]
Как известно, молекулы белка построены из большого числа аминокислот. Поэтому при изучении структуры белка методом ИК-спектроскопии нельзя просто воспользоваться теми данными, которые были получены при исследовании полипептидов. В работе [137] изучали зависимость конформации от состава аминокислот для тех синтетических полипептидов, которые моделируют составные части белков. Было показано [1895, 1896], что при денатурировании дезоксирибонуклеиновых кислот в их спектрах исчезают полосы при 1645 и 1680 см и вместо них появляются полосы при 1660 и 1690 см- . Первые две полосы соответствуют регулярным водородным связям между звеньями пурина и пиримидина, которые придают прочность двойной спирали. Исследования проводили с использованием растворов в тяжелой воде. В работе [136] обсуждается необходимость спектроскопического изучения биополимеров, находящихся в Н2О и ВгО, поскольку эти жидкости являются их естественными растворителями. Там же рассмотрены соответствующие методики исследования. Изучены конформацион-ные изменения, происходящие при денатурации белков плазмы крови [1314, 1315J. Исследованы колебания пролинового кольца в пoли-L-пpoлинe [257, 259], который является составной частью многих белков. Был сделан вывод, что полосу при 1440 см можно использовать только для определения содержания остатков иминокислот в молекуле полипептида. [c.344]
Хашимото и Пигман [55] обратили внимание на то, что в белковой части подчелюстных гликонротеинов быка, овцы и собаки, в подъязычном и цервикальном гликопротеинах быка и в групповых веществах крови А, Н и Ье из жидкостей кисты яичника количество остатков глицина, серина и треонина (существует обратное отношение между глицином и суммой окси-аминокислот) составляет примерно половину общего содержания аминокислот. Такое преобладание определенных аминокислот в гликопротеинах слизистых выделений весьма интересно и может быть использовано впоследствии для подразделения гликопротеинов на большие группы. [c.34]
Эритроциты в крови можно по ряду свойств рассматривать так же, как частички гидрофобной эмульсии. На их поверхности адсорбированы молекулы белков, аминокислот и ионы электролитов. Все они сообщают эритроцитам определенный отрицательный заряд, а противоионы создают некоторый диффузный слой. При различных патологических процессах в организме, когда в кровн увеличивается содержание некоторых видов белков (либо особого глюкопротеида, относящегося к а-глобулинам, либо при инфекционных заболеваниях Y-глoбyлинoв), происходит процесс, очень напоминающий ионообменную адсорбцию место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещенных ими ионов. В результате заряд эритроцитов понижается, они быстрее объединяются и оседают (ускоряется реакция оседания эритроцитов — РОЭ). Этот процесс зависит еще от ряда факторов содержания других белковых фракций и мукополисахаридов, концентрации эритроцитов в крови, наличия в крови микробов, наконец, расположения сосуда, в котором наблюдается РОЭ (в частности, скорость ее выше в наклонно расположенном капилляре). Оседание эритроцитов протекает сходно с процессом седиментации гидрофобного коллоида. Как показали исследования при помощи микрокинематографии (Кигезен), к имеющимся в крови агрегатам и монетным столбикам присоединяются отдельные эритроциты укрупнившиеся агрегаты оседают вначале быстро, а потом медленнее, так как в нижних частях капилляров их расположение становится настолько плотным, что частично сохранившиеся у них заряды начинают в большей мере противодействовать сближению частиц. Структура этого осадка напоминает губку чтобы его уплотнить, необходимо выжать оттуда воду, причем чем плотнее осадок, тем труднее это достигается. Поэтому в клинических исследованиях обычно не ожидают завершения оседания эритроцитов, а регистрируют результаты спустя 1—2 ч после начала реакции. Учитывая, что скорость процесса меняется на разных этапах, было предложено изучение его динамики измерением величины оседания эритроцитов каждые 15—30 мин (так называемая фракционная РОЭ). Этот метод представляет значительный интерес и находит широкое применение. [c.167]
Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и трипептидом глутатионом приходится более 50% а-аминоазота головного мозга. В мозге содержится ряд свободных аминокислот, которые лишь в незначительных количествах обнаруживаются в других тканях млекопитающих. Это у-амино масляная кислота, К-ацетиласпарагиновая кислота и цистатионин (см. главу 1). [c.634]
Некоторые величины, приведенные в таблице, являются приблизительными и основываются на небольшом числе определений тем не менее они дают представление о порядке величин, характеризующих содержание аминокислот в перечисленных биологических объектах. Другие данные о содержании свободных аминокислот в животных тканях, в моче и плазме крови человека и в растениях можно найти в статьях Таллана, Мура и Стайна [303], Стайна [307], Стайна и Мура [326] и Стюарда и Томпсона [340]. [c.65]
Что касается аминокислот, входящих в состав гликопротеинов, то последние представлены чаще всего во всем их разнообразии, хотя можно отметить несколько интересных особенностей. Так, содержание ароматических и серусодержащих аминокислот обычно очень невелико. Отмече-но , что все известные гликопротеины по аминокислотному составу могут быть разделены на две довольно определенные группы. Гликопротеины одной группы, содержащие небольшой процент сахаров и близко стоящие к белкам, имеют обычный стандартный набор аминокислот к этой группе относятся гликопротеины плазмы и многие другие углеводсодержащие белки. Гликопротеины второй группы содержат относительно меньше аминокислот, но состав этих аминокислот более специфичен наиболее характерным признаком этой группы гликопротеинов является очень высокая доля оксиаминокислот (серина и треонина), которые в отдельных случаях, например в групповых веществах крови, составляют половину всех аминокислот аномально высоким бывает также содержание пролина и глицина. [c.568]
Исследование процессов синтеза белка в печени основывается на определении включения меченых свободных аминокислот в состав белковых молекул (И. П. Уланова, П. Г. Гарка-ви, 1961), а также на выявлении нарушений нормальных соотношений между отдельными белковыми фракциями. Для этой цели может быть использован метод электрофореза. При условии одновременного определения общего белка сыворотки крови этот метод позволяет выражать данные протеинограммы не в относительных, а в абсолютных величинах (в грамм-процентах), что дает более объективную информацию о содержании отдельных белковых фракций. [c.190]
Большой клинический интерес представляет определение белка в сыворотке крови. Голодание организма или малобелковая диета приводит к гипопротеи не ми и, т.е. к понижению содержания белков в крови. При этом происходит нарушение синтеза мочевины, процессов дезаминирования, окисления фенилаланина и других аминокислот. Нарушение указанных процессов связано с недостаточным синтезом ферментов или с интенсивным распадом тканевых белков. [c.233]
Полипептиды. Часть полипептидов поступает в кровь из кишечника при переваривании белков (стр. 328) другая часть является промежуточными продуктами распада белков тканей. Определение полипептидов, как и аминокислот, в плазме или сыворотке производится после удаления белков. Освобождение плазмы или сыворотки от белков достигается осаждением их трихлоруксусной кислотой, фосфорновольфрамовой кислотой и др. (стр. 23). В зависимости от способа удаления белков получаются различные числа, характеризующие содернсанпе полипептидов в плазме или сыворотке. Обычное содержание азота полипептидов составляет в норме от 0,1 до 3 мг%. [c.479]
Ранее [227] считали, что групповые вещества крови являются непосредственно продуктами генов. Однако в последнее время были достигнуты очень крупные успехи в изучении функции генов на биохимическом уровне, в результате чего стало ясно, что эта точка зрения, по всей вероятности, ошибочна [228]. Теперь известно, что в дезоксирибонуклеиновой кислоте (ДНК) заложена информация, определяющая последовательность аминокислот в белках следовательно, функция генов групповых веществ заключается, очевидно, в том, что они определяют образование (через соответствующие промежуточные продукты) каких-то специфических белков, которые либо сами обладают ферментативной активностью, либо контролируют ферменты, участвующие в синтезе углеводов. Исходя из этого предположения, можно считать, что гены А, В, Н и Ье являются трансформирующими и контролируют определенные стадии превращения вещества-предшественника в специфические соединения, появляющиеся в секретах. Ген О (третий аллель Л50-локуса), ген к (аллель гена Н) и ген 1е (аллель гена Ье) не принимают участия в превращении вещества-предшественника. Согласно предложенной схеме, их можно рассматривать как неактивные гены. Вещество-предшественник считают макромолекулнрным гликопротеином с полностью синтезированными пептидными цепями и с углеводными цепями, уже присоединенными к макромолекуле, но еще не окончательно достроенными. Такой гликопротеин, очень сходный по своему составу и свойствам с групповыми веществами крови и отличающийся от них лишь очень низким содержанием фукозы, находят и в секретах тех немногих индивидуумов, у которых отсутствуют вещества А, В, Н, Ье и Ье [5, 21]. Эти соединения, дающие сильно выраженную реакцию преципитации с лошадиной антисывороткой к пневмококку тина XIV, очевидно, можно рассматривать как вещество-предшествен-ник в биосинтезе групповых веществ крови. [c.208]
chem21.info
Современный напряженный ритм жизни сопровождается увеличением числа заболеваний, таких, как инфаркт, гипертония, ожирение, кариес зубов и всевозможные виды аллергии (т. е. чрезмерной чувствительности организма к специфическим внешним раздражителям, называемым аллергенами). Для всех этих болезней характерно повышенное содержание в крови гистамина — вещества, образующегося при декарбоксилировании аминокислоты гистидина [c.205]
После того как вы съели какой-нибудь белок, ферменты, называемые протеазами, разрывают пептидные связи. Происходит это в желудке и тонком кишечнике. Свободные аминокислоты переносятся током крови сначала в печень, а потом во все клетки. Там из них синтезируются новые белки, необходимые организму. Если в организм поступило белка больше, чем надо, или организму требуется сжечь белки из-за недостатка углеводов, то эти реакции аминокислот происходят в печени здесь азот из аминокислот образует мочевину, выделяемую из организма с мочой через мочевыводящую систему. Именно поэтому белковое питание дает лишнюю нагрузку на печень и почки. Оставшаяся часть молекулы аминокислоты либо перерабатывается в глюкозу и окисляется, либо превращается в жировые запасы. [c.262]
Аминокислоты. Поступившие в кровь аминокислоты, подобно полипептидам, являются или продуктом распада тканевых белков, или продуктом переваривания пищевых белков в кишечнике. Во время пищеварения количество аминокислот в крови возрастает. В транспорте аминокислот большую роль играют эритроциты. [c.250]
Изучение строения белков позволило в ряде случаев вскрыть химическую первопричину некоторых болезней. Так, при тяжелом наследственном заболевании — серповидной анемии — больным оказывается белок крови — гемоглобин в нем содержится одна неправильная аминокислота. Наблюдения такого рода имеют огромное значение не только для биологии как науки, но [c.336]
В клетках и тканях синтез белков начинается с использования аминокислот. В организмах зеленых растений образуются все аминокислоты, из которых синтезируются белки. У животных из кишечника поступают в кровь аминокислоты, из которых в тканях синтезируются белки. В первом и во втором случае из аминокислот синтезируются определенные, свойственные данным организмам, белковые вещества. Как же осуществляется этот синтез До последнего времени на поставленный вопрос нельзя было дать какой-либо удовлетворяющий ответ. Результаты исследований только. чишь последнего времени в значительной мере позволяют разобраться в сложных процессах, приводящих к синтезу белков в клетках и тканях организмов. [c.426]
В таких комплексах центральный атом и связ анные с ним группы расположены в одной плоскости. Аналогично построенные, но менее прочные / п+ -комплексы аминокислот часто обладают свойством повышать содержание сахара в крови, подобно гормону поджелудочной железы глюкагону (стр. 885). Комплексы аминокислот с тяжелыми металлами могут стабилизоваться при участии боковых [c.354]
Отрицательная и положительная адсорбция различных веществ в крови и протоплазме клеток имеет большое значение для обмена веществ в живых организмах. Поверхностное натяжение биологических жидкостей значительно ниже, чем воды (табл. 32). Поэтому гидрофобные вещества, например кислоты жирного ряда, аминокислоты, стероиды, будут накапливаться у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны. [c.133]
Т Установлено, что предшественниками белков молока являются достав ляемые к молочной железе с кровью аминокислоты, а также белки плазмы крови, главным образом, глобулины. Полагают, что 30—45% белков молока синтезируются за счет доставляемых аминокислот, а остальное количество-за счет белков крови, без предварительного распада их иа аминокислоты. Некоторое количество аминокислот подвергается в молочной железе деза минированию и образующиеся из них сс-кето кис лоты либо полностью распадаются и в этом случае они используются для энергетических целей, либо он I превращаются в другие органические вещества (жиры, углеводы). [c.530]
Все биохимические процессы проходят в разбавленных водных растворах. Наиболее концентрированные растворы содержат лишь 7—9% белков (плазма крови). Известно, что протеолитические ферменты, ускоряющие гидролиз белков до дикетопиперазинов и даже свободных а-аминокислот, могут проводить процесс в обратном направлении. [c.507]
После приема пищи, богатой белками, из внутренних органов поступают в кровь аминокислоты, среди которых преобладают соединения с разветвленной боковой цепью (рис. 30.12). На долю валина, изолейцина и лейцина приходится по меньшей мере 60% от общего количества аминокислот, поступающих в общую систему кровообращения (в отличие от воротной системы), даже в тех случаях, когда на долю этих аминокислот в составе белков пищи прихо- [c.312]
Чтобы наглядно представить роль и значение адсорбционных процессов, протекающих в животном организме, рассмотрим адсорбционные возможности эритроцитов крови человека. Исследования показали, что эритроциты являются переносчиками различных веществ, в том числе аминокислот, которые они разносят и передают клеткам и различным тканям организма. Количество эритроцитов в. крови взрослого человека примерно 5 ООО ООО в 1 нм . У здорового мужчины в среднем на 1 кг массы приходится 450 миллиардов эритроцитов, 27 триллионов на весь организм. Учитывая, что диаметр эритроцита 7—8 мкм, можно легко подсчитать, что общая поверхность эритроцитов всей крови человека составит примерно 3200 м [c.366]
В сложных химических и биологических процессах нередко количество какого-то вещества остается постоянным не потому, что с веществом ничего не происходит, а потому, что количество вещества, образующегося из каких-либо предшественников, и количество вещества, исчезающего за тот же промежуток времени в результате свойственных ему превращений, оказывается одинаковым. Например, содержание белков в плазме крови в норме остается приблизительно постоянным однако на самом деле они непрерывно обновляются. Это нетрудно зарегистрировать, если ввести в кровь меченые аминокислоты, из которых синтезируются белки. При этом, помещая в счетчик радиоактивности белки, взятые через разные отрезки времени после инъекции аминокислот, можно увидеть, что белки становятся радиоактивными и их радиоактивность нара- [c.32]
Электрофореграммы плазмы крови в. норме у всех людей дают почти одну и ту же картину (рнс. 84, а). Для патологии характерна совершенно иная и специфическая для каждого заболевания картина (рис. 84,6). Следовательно, электрофореграммы могут быть успешно использованы как для диагноза, так и для контроля за ходом болезни и нормализацией белкового состава крови. Метод широко используют также для разделения аминокислот, антибиотиков, ферментов, антител и других объектов. [c.215]
Все известные ферменты представляют собой длинные цепи из а-амино-кислот (относительная молекулярная масса порядка 0,5 млн), свернутые в компактную форму, в которых имеется несколько реакционноспособных участков. Изучение природы ферментов показало, что, помимо белка, многие из них содержат и другие соединения. Так, например, в составе окислительных ферментов были обнаружены органические соединения железа. Эти соединения у различных окислительных ферментов оказались одинаковыми по составу. Кроме того, было выяснено, что такие же соединения железа входят и в гемоглобин крови, переносящий кислород в организме человека и животных. Комплексное соединение железа (гем) можно отделить от белка. Однако после этого ни белок, ни гем не проявляют ферментативных свойств. Отсюда следует, что высокая активность и специфичность свойственны только сложной системе, состоящей из белка и гема. В состав различных ферментов входят и комплексные соединения других металлов. В некоторых ферментах обнаружены медь, цинк, марганец, хром и другие элементы. Для некоторых ферментов уже известна первичная структура, т. е. последовательность аминокислот в длинной цепи. Вторичная структура — общий характер спирали, образуемый цепью, приближенно установлена для нескольких ферментов. О третичной структуре, т. е. природе реакционноспособных поверхностных участков молекулы, известно очень мало. [c.149]
Таким образом, сама жизнь организма зависит от способности крови регулировать pH в определенных пределах. А это достигается содержанием в крови ацетатных, фосфорных и карбонатных буферных систем, а также систем с таким же действием из аминокислот и белков. [c.180]
Биологические функции никеля еще мало исследованы. Есть основания считать его микроэлементом. В организмах никель активирует многие ферменты, усиливает синтез серосодержащих аминокислот. При одновременном присутствии железа и никеля улучшается образование гемоглобина в крови животных. [c.431]
Метаболизм аминокислот, жирных кислот. Синтез гемоглобина, участвует в поддержании уровня глюкозы в крови Образование красных кровяных клеток, работа нервной ситемы [c.271]
Гидролиз белков, по существу, сводится к гидролизу полипептид-ных связей. К этому же сводится и переваривание белков. При пищеварении белковые молекулы гидролизуются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал. [c.352]
Химический состав опорных тканей позвоночных отличается от состава скелетных тканей беспозвоночных — спонгина, хитина и др. В покровах позвоночных присутствует особый белок - кератин. Позвоночные отличаются от беспозвоночных и действием пищерастительных ферментов, более высоким отношением (Ма + К)/ Са + Мд) в жидкой фазе внутренней среды. Среди беспозвоночных только у оболочников есть целлюлозная оболочка, имеется ванадий в крови в особых окрашенных клетках, а у круглоротых - соединительно-тканный скелет и хрящ, а также особый дыхательный пигмент — аритрокруорин с наименьшей для позвоночных молекулярной массой (17 600). Отличительная черта сипункулид — древних групп морских беспозвоночных - наличие специального переносчика кислорода - гемэритрина и наличие в эритроцитах значительного количества аллантоиновой кислоты. Для насекомых характерно высокое содержание в крови аминокислот, мочевой кислоты и редуцирующих и несбраживаемых веществ, в хитиновом покрове отсутствуют смолы, для членистоногих — наличие специфической (только для их групп) фенолазы в крови. Таким образом, можно констатировать, что систематические группы животных имеют свои биохимические особенности. Такие же особенности наблюдаются и у растений для различных систематических групп - наличие специфических белков, жиров, углеводов, алкалоидов, глюкозидов, ферментных систем. [c.189]
Следует отметить, что фермент, катализирующий окислительное декарбоксилирование указанных а-кетокислот, высокоспецифичен (по аналогии с пируватдегидрогеназным и а-кетоглутаратдегидрогеназным комплексами) и также нуждается в присутствии всех пяти кофакторов (см. главу 10). Известно наследственное заболевание болезнь кленового сиропа , при которой нарушено декарбоксилирование указанных а-кетокислот (вследствие синтеза дефектного дегидрогеназного комплекса), что приводит не только к накоплению в крови аминокислот и а-кетокислот, но и к их экскреции с мочой, издающей запах кленового сиропа. Болезнь встречается редко, проявляется обычно в раннем детском возрасте и приводит к нарушению функции мозга и летальному исходу, если не ограничить или полностью не исключить поступление с пищей лейцина, изолейцина и валина. [c.459]
Применив А. С. Коникова, М. Г. Крицман, В. Н. Орехович и др. [1487] нашли, что кровь содержит ферменты, которые синтезируют и обновляют аминокислоты и белки. К крови добавлялись NaH Юз, NHj l, аланин, пировиноградная, кетоглютаровая и фумаровая кислоты. Через день выделенные из крови аминокислоты содержали Теми же авторами были произведены аналогичные опыты по изучению синтеза аминокислот в печени. [c.507]
Большое значение имеет комплексообразование железа с биолигандами [2, с. 165—184]. Особенно важен гемоглобин — железосодержащая белковая молекула, выполняющая в крови животных и человека функции переносчика кислорода. Гемоглобин содержит белок глобин и четыре гема , представляющих собой порфириновый комплекс железа (II), где атом железа образует связь с четырьмя атомами азота порфиринового кольца и одну связь с атомом азота гистидина— аминокислоты, входящей в состав б1елка глобина. Шестое место в координационной сфере железа (II) может быть занято молекулярным кислородом О2, а также лигандами типа СО, СЫ и др. Если гемоглобин вступил во взаимодействие, например, с СО, он теряет способность обратимо присоединять О2. В таком случае организм погибает от гипоксии. Этим объясняется высокая токсичность СО, СК - и подобных им лигандов. [c.134]
ГЛЮКОНЕОГЕНЕЗ. Когда в связи с расходованием глюкозы запасы гликогена в печени истощаются, глюкоза может синтезироваться из любого неуглеводного предшественника. Этот процесс называется глюконеогенезом. Происходит он при истощении запасов гликогена в печени. Низкий уровень глюкозы в крови (гипогликемия) стимулирует посредством симпатической нервной системы выброс адреналина, который, как уже отмечалось, способствует сиюминутному удовлетворению потребностей организма в глюкозе. Низкий уровень глюкозы в крови приводит также к стимуляции гипоталамуса, который выделяет кортиколиберин (разд. 17.6.5), вызывающий секрецию адренокортикотропного гормона (АКТГ) передней долей гипофиза. Под действием АКТГ усиливается синтез и высвобождение глюкокортикоидных гормонов (в основном кортизола, известного также как гидрокортизон). Эти гормоны стимулируют переход из тканей в кровь аминокислот, глицерола и жирных кислот, а также синтез в печени ферментов, катализирующих превращение аминокислоты и глицерола в глюкозу, т. е. осуществляют глюконеогенез. Жирные кислоты расщепляются с образованием ацетилкофер-мента А, а затем окисляются в цикле Кребса. [c.425]
Из кишечника главная масса аминокислот поступает непосредственно в кровь. Через лимфатические сосуды всасывается пе более 5% пищевого азота. С кровью по воротной вене аминокислоты доставляются в первую очередь к печени, где значительная доля их используется для синтеза белков или подвергается другим превращениям. Часть из них поступает в общий кровопоток. В циркулирующую кровь аминокислоты поступают так-> се из всех других органов, где они непрерывно освобождаются в результате распада тканевых белков. Но в то же время все ткани поглощают аминокислоты из крови (через межклеточную жидкость) и расходуют их для построения своих специфических белков и других продуктов азотистого обмена. В результате этих противоположно направленных процессов содержание аминокислот (и низших пептидов) в крови поддерживается на относительно постоянном уровне. [c.252]
Нарушения переваривания и всасывания белков могут быть вызваны следующими причинами 1) дефицит пепсина, который возникает при частичной резекции желудка за счет уменьшения секреции пепсиногена клетками слизистой (их количество сокращено) 2) дефицит пепсина вследствие низкой скорости превращения пепсиногена в пепсин при пониженной кислотности (низкое содержание соляной кислоты) в результате этого белки не полностью гидролизуются и вся нагрузка по их дальнейшему перевариванию ложится на тонкий отдел кишечника 3) дефицит трипсина, энтеропептидазы, карбоксипептидазы, который возникает как результат смещения pH в сторону более кислой среды и ряда патологий в результате негидролизованные белки и пептиды не могут всосаться в стенки кишечника и поступают в тонкий отдел, где подвергаются массовому гниению, при этом происходит автоинтоксикация организма на фоне низкого содержания в крови аминокислот 4) нарущение работы цикла всасывания аминокислот из-за дефицита любого фермента, катализирующего эти реакции. [c.394]
Ряд органических соединений, присутствующих в среде, снижает антибактериальные свойства стрептомицина. К ним относятся нуклеиновые кислоты, пептон, сыворотка крови, аминокислоты, глюкоза, некоторые соли органических и неорганических кислот. Например, добавление к среде солей пировиноградной или фумаровой кислот в концентрации 1% создает условия, при которых Е. соИ развивается в присутствии 10 мкг/мл стрептомицина, а если концентрацию солей повысить до 3%, то рост бактерий наблюдается и при 150 мкг/мл антибиотика. Защитное действие этих и некоторых других кислот специфично. Стрептомицин в этих условиях не разрушается, но возрастает устойчивость бактерий к нему. У Е. соН такая устойчивость проявляется в большой степени, в то время как у Staph, aureus эти кислоты почти не вызывают защитных свойств. [c.245]
Гидролиз белков, по существу, сводится к гидролизу полипептид-ных связей, К этому же сводится и переваривание белков. При пищеварении белковые молекулы гидрхорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и кл(тки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть - на синтез гормонов, ферментов и других биологически важных веществ, а остальные лужат как энергетический материал. Развитие новых экспериментальных методов исследования в органической химии обусловило успехи в изучении структуры белка, В настоящее время раапичают первичную, вторичную и третичную структуры белковой молекулы. [c.420]
Способность печени обезвреживать кровь ограничен а. Перегрузка опасными веществами может оказаться слишком обременительной для нее. В результате функции печени могут подавляться, что вызовет проблемы в распределении необходимых молекул - глюкозы и аминокислот - и в синтезе важных белков. Перегрузка печени может привести также к накоалению вредных молекул в жировых запасах тела. [c.486]
К этому методу близок метод вивидиализа (вивидиффузии) для прижизненного определения в крови низкомолекулярных составных частей. Для проведения анализа в концы перерезанного кровеносного сосуда вставляют стеклянные канюли, разветвленные части которых соединены между собой трубками из полупроницаемого материала, и всю систему помещают в сосуд, заполняемый физиологическим раствором соли или водой. Таким путем было найдено, что в крови помимо свободной глюкозы находятся свободные аминокислоты. [c.421]
Изучение строения белков-гормонов и других белков, выполняющих важные физиологические функции, позволило в ряде случаев вскрыть химическую первопричину некоторых болезней. Так, при тяжелом наследственном заболевании, так называемой серповидной анемии, больным оказывается белок крови гемоглобин. Его заболевание заключается в том, что в сложной структуре этого белка всего одна аминокислота заменена другой. Подобных молекулярных болез.чен (термин, предложенный известным американским ученым Полингом) в настоящее время известно несколько. [c.344]
У растений остов растительной клетки образует клетчатка, но и здесь белки выполняют жизненно важные функции, сосредоточиваясь в основном в семенах. Растения способны синтезировать аминокислоты и белки, используя в качестве источника азота неорганические соединения, животные же для нормального существования должны получать белки с пищей. В процессе пищеварения белки расш,енляются на амшюкислоты, которые током крови разносятся по всему организму и служат строительным материалом для создания белков животных организмов. [c.332]
Примерно на том же принципе основано прижизненное определение низкомолекулярных составных частей крови методом вивидиализа (вивидиф-фузия по Абелю). В концы перерезанного кровеносного сосуда вставляются стеклянные канюли, разветвленные части которой соединяются между собой трубочками из коллодия, и вся система погружается в сосуд, заполняемый физиологическим раствором Na l или водой (рис. 37). Было установлено, что аминокислоты в крови, так же как и глюкоза, могут находиться в свободном состоянии. [c.119]
Эритроциты в крови можно по ряду свойств рассматривать так же, как частички гидрофобной эмульсии. На их поверхности адсорбированы молекулы белков, аминокислот и ионы электролитов. Все они сообщают эритроцитам определенный отрицательный заряд, а противоионы создают некоторый диффузный слой. При различных патологических процессах в организме, когда в кровн увеличивается содержание некоторых видов белков (либо особого глюкопротеида, относящегося к а-глобулинам, либо при инфекционных заболеваниях Y-глoбyлинoв), происходит процесс, очень напоминающий ионообменную адсорбцию место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещенных ими ионов. В результате заряд эритроцитов понижается, они быстрее объединяются и оседают (ускоряется реакция оседания эритроцитов — РОЭ). Этот процесс зависит еще от ряда факторов содержания других белковых фракций и мукополисахаридов, концентрации эритроцитов в крови, наличия в крови микробов, наконец, расположения сосуда, в котором наблюдается РОЭ (в частности, скорость ее выше в наклонно расположенном капилляре). Оседание эритроцитов протекает сходно с процессом седиментации гидрофобного коллоида. Как показали исследования при помощи микрокинематографии (Кигезен), к имеющимся в крови агрегатам и монетным столбикам присоединяются отдельные эритроциты укрупнившиеся агрегаты оседают вначале быстро, а потом медленнее, так как в нижних частях капилляров их расположение становится настолько плотным, что частично сохранившиеся у них заряды начинают в большей мере противодействовать сближению частиц. Структура этого осадка напоминает губку чтобы его уплотнить, необходимо выжать оттуда воду, причем чем плотнее осадок, тем труднее это достигается. Поэтому в клинических исследованиях обычно не ожидают завершения оседания эритроцитов, а регистрируют результаты спустя 1—2 ч после начала реакции. Учитывая, что скорость процесса меняется на разных этапах, было предложено изучение его динамики измерением величины оседания эритроцитов каждые 15—30 мин (так называемая фракционная РОЭ). Этот метод представляет значительный интерес и находит широкое применение. [c.167]
Превращение белков в организме. В организмах животных и человека под влиянием ферментов (пепсина, трипси--на, эрепсина и др.) происходит гидролиз белков. В результате этого образуются аминокислоты, которые всасываются ворсинками кишечника в кровь и используются для образования белков, специфических данному организму. Синтез белков идет с поглощением энергии. Эту энергию доставляют молекулы АТФ. (Повторите из учебника Общая биология 42.) В организме одновременно с синтезом белков непрерывно происходит и полное их разрушение, вначале до аминокислот, а затем до оксида углерода (IV), аммиака, мочевины и воды. При этих процессах выделяется энергия, но Б меньшем количестве, чем при распаде углеводов и жиров. [c.21]
chem21.info
Аминокислоты — органические кислоты, молекулы которых содержат одну или несколько аминогрупп (Nh3-группы). Представляют основные структурные элементы белков. Белки пищи в организме человека расщепляются до аминокислот. Определенная часть аминокислот, в свою очередь, расщепляется до органических кетокислот, из которых в организме вновь синтезируются новые аминокислоты, а затем белки. В природе обнаружено свыше 20 аминокислот.
Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным превращениям. В крови поддерживается постоянная концентрация аминокислот. Из организма выделяется около 1 г азота аминокислот в сутки. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Концентрация аминокислот в крови позволяет судить о функциональном состоянии печени и почек. Содержание аминокислот в крови может заметно нарастать при нарушениях функции почек, лихорадочных состояниях, заболеваниях, связанных с повышенным содержанием белка.
Аминокислоты подразделяются на незаменимые (валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин), частично заменимые (аргинин и гистидин) и заменимые (аланин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, тирозин, цистеин).
Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. Оптимальное содержание незаменимых аминокислот в пищевом белке зависит от возраста, пола и профессии человека, а также от других причин. Заменимые аминокислоты синтезируются в организме человека.
Аминокислоты представляют собой структурные химические единицы, образующие белки.
Любой живой организм состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками.
Дефицит белков в организме может привести к нарушению водного баланса, что вызывает отеки. Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания.
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма так некоторые из них:
В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. К таким незаменимым аминокислотам относятся:
Аминокислоты, которые синтезируются в печени, включают:
Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным нарушениям — от расстройств пищеварения до депрессии и замедления роста.
Многие факторы приводят к этому, даже, если ваше питание сбалансировано, и вы потребляете достаточное количество белка. Нарушение всасывания в желудочно-кишечном тракте, инфекция, травма, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме — все это может привести к дефициту незаменимых аминокислот.
В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок. Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
При выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты. Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин. D означает dextra (правая на латыни), a L — levo (соответственно, левая). Эти термины обозначают пространственное строение данной молекулы. Белки животных и растительных организмов созданы L-формами аминокислот (за исключением фенилаланина, который представлен D,L- формами). Таким образом, только L-аминокислоты являются биологически активными участниками метаболизма.
Свободные, или несвязанные, аминокислоты представляют собой наиболее чистую форму. Они не нуждаются в переваривании и абсорбируются непосредственно в кровоток. После приема внутрь всасываются очень быстро и, как правило, не вызывают аллергических реакций.
Войдите на сайт, чтобы оставлять комментарии
www.butakova.com
Аминокислоты в крови являются особыми структурными химическими единицами, которые образуют белки. Многие из них вырабатываются в печени, но некоторые не могут быть синтезированы, поэтому их необходимо восполнять с пищей. Помимо того, что они участвуют в образовании белков, входящих в состав тканей и органов организма человека, некоторые из них:
 Нужны в метаболизме, иммунных и ферментативных реакциях большинства биологических веществ, процессах детоксикации, а также они выполняют регуляторную функцию и другие.
Нужны в метаболизме, иммунных и ферментативных реакциях большинства биологических веществ, процессах детоксикации, а также они выполняют регуляторную функцию и другие.Если организм человека испытывает нехватку одной из аминокислот, то начинаются серьезные проблемы, которые приводят к депрессии, ожирению, почечной недостаточности, проблемам с пищеварением и т.д., вплоть до замедления роста и развития. В особой группе риска находятся спортсмены, поддерживающие положительный азотный баланс при помощи анаболических препаратов и спортивного питания. В силу исключения из рациона многих необходимых продуктов туда попадают также вегетарианцы, веганы и худеющие при помощи диет специфического характера.
Анализ на аминокислоты в крови и моче признан незаменимым способом оценки и определения достаточного их содержания, степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе хронических заболеваний печени, почек, дыхательных органов, сердечно-сосудистой системы.
Аминокислоты включают в себя 12 показателей: аргинин, аланин, аспарагиновую и глутаминовую кислоты, цитруллин, метионин, глицин, орнитин, валин, фенилаланин, тирозин, отношение – лейцин/изолейцин.
 Аланин участвует в нормализации метаболизма углеводов и является составной частью пантеноловой кислоты (витамин В5) и коэнзима А, который производит необходимую энергию для мышечной деятельности. Он замедляет рост новообразований, в том числе злокачественных, за счет стимуляции иммунной системы. Увеличивает размер и улучшает активность вилочковой железы, которая вырабатывает Т-лимфоциты (защищают организм от опухолевых клеток и сигнализируют о начале синтеза антител), а также улучшает детоксикационные процессы в печени (обезвреживание аммиака).
Аланин участвует в нормализации метаболизма углеводов и является составной частью пантеноловой кислоты (витамин В5) и коэнзима А, который производит необходимую энергию для мышечной деятельности. Он замедляет рост новообразований, в том числе злокачественных, за счет стимуляции иммунной системы. Увеличивает размер и улучшает активность вилочковой железы, которая вырабатывает Т-лимфоциты (защищают организм от опухолевых клеток и сигнализируют о начале синтеза антител), а также улучшает детоксикационные процессы в печени (обезвреживание аммиака). Глицин снижает дегенерацию мышечной ткани, поскольку является источником вещества, содержащегося в мышцах и используемого при синтезе ДНК и РНК - креатина. Выполняет функцию тормозного нейромедиатора и предотвращает эпилептические судороги. Он служит для синтеза желчных и нуклеиновых кислот, а также заменимых аминокислот.
Глицин снижает дегенерацию мышечной ткани, поскольку является источником вещества, содержащегося в мышцах и используемого при синтезе ДНК и РНК - креатина. Выполняет функцию тормозного нейромедиатора и предотвращает эпилептические судороги. Он служит для синтеза желчных и нуклеиновых кислот, а также заменимых аминокислот.Исследования врачей показали, что нехватка аминокислот приводит к недостаточности всех синтетических процессов в человеческом организме. Быстрообновляющиеся системы (гуморальная и половая, костный мозг и др.) страдают в особенности.
Наследственные нарушения, характеризующиеся изменением концентрации аминокислоты в крови и ацилкарнитинов представляют собой наиболее многочисленную гетерогенную группу болезней метаболизма (тирозинемия, ФКУ, гистидинемия, гиперглицинемия и др.). Значения точной лабораторной диагностики этих заболеваний определяется тем, что часто их формы имеют схожую клиническую картину, что усложняет процесс выявления болезни. Избыточное накопление и повышение уровня многих аминокислот имеет токсическое воздействие.
www.chromolab.ru
ГО промежуточного продукта цикла лимонной кислоты и углеродные скелеты многих аминокислот способны превращаться в глюкозу. Из жирных кислот с четным числом атомов углерода и из ацетил-СоА реального образования глюкозы не происходит, тогда как три углеродных атома жирных кислот с нечетным числом атомов углерода, а также образуемый бактериями рубца пропионат могут превращаться в глюкозу при этом в качестве промежуточного продукта образуется метилмалонил-СоА, превращающийся затем в сукци-нил-СоА при участии кофермента Bi2-В периоды восстановления после напряженной мышечной работы глюконеогенез протекает очень активно, благодаря чему присутствующий в крови лактат превращается в гликоген и глюкозу. [c.618]
При потреблении обычной пищи здоровый организм в нормальных условиях выделяет столько же азота, сколько и потребляет в этом случае говорят об азотистом балансе. Это равновесие обеспечивается наличием ряда факторов. Всосавшиеся аминокислоты пищи попадают в так называемый общий азотный фонд. Азотный фонд — это не какое-нибудь специальное депо под термином азотный фонд подразумеваются все аминокислоты, присутствующие в организме (т. е. в крови, внутриклеточной и межклеточной жидкостях), а также и все остальные азотсодержащие соединения. Аминокислоты, входящие в азотный фонд, могут образовываться и из тканевых белков, которые постоянно расщепляются и синтезируются вновь,— ведь большинство тканевых белков находится в состоянии динамического равновесия. Аминокислоты, из которых построены эти белки, постоянно обновляются. Особенно быстро обновляются аминокислоты в белках печени и плазмы крови и очень медленно — в мышечных белках. [c.402]
Биологические функции никеля еще мало исследованы. Есть основания считать его микроэлементом. В организмах никель активирует многие ферменты, усиливает синтез серосодержащих аминокислот. При одновременном присутствии железа и никеля улучшается образование гемоглобина в крови животных. [c.431]
В крови человека всегда содержится некоторое количество конечных продуктов азотистого обмена, находящихся на пути к удалению из организма, а также промежуточные продукты распада ряда веществ. В первую очередь здесь надо отметить присутствие в плазме и сыворотке крови п о-л и пептидов и аминокислот. [c.442]
Различные вещества, присутствующие также Б крови и моче мочевина, аммиак, холестерин, аминокислоты, мочевая кислота pH слюны в среднем 6,8 [c.365]
Нуклеиновые кислоты присутствуют в клетке в связанном состоянии, в соединении с белками. Очень мало известно о комбинациях РНК с белком, но белки, связанные с ДНК, были изучены Мишером и его последователями. Мишер обнаружил в ядрах сперматозоидов лосося необычный белок, связанный с фосфорной кислотой ДНК, более щелочной и более простой по своему строению, чем обычные белки. В нем отсутствуют многие аминокислоты, которые есть в большинстве белковых молекул. Название этого белка знакомо больным диабетом— это протамин, белок, который добавляют в инсулин, чтобы последний дольше задерживался в крови. Вот, кстати, прекрасный пример того, какое неожиданное применение часто может найти научное открытие. Кто мог бы предположить, что этот открытый Мишером в сперме лосося своеобразный белок будет со временем применяться вместе с гормоном поджелудочной железы для лечения такого опасного заболевания, как диабет. [c.117]
Для примера приведем серотонин (1) (также называемый 5-гидрокситриптамин, или 5-НТ). Это соединение широко распространено в природе, но встречается в очень низких концентрациях. В живых системах он образуется из аминокислоты триптофан гид-роксилированием по положению 5 индольного ядра с последующим декарбоксилированием. Впервые серотонин был выделен из природных продуктов в 1948 г. как сосудосуживающее средство, присутствующее в сыворотке крови, а впоследствии был обнаружен в пищеварительной системе и в мозгу. Однако только лабораторный синтез несколько лет спустя значительно расширил возможности для изучения механизма его действия. Сейчас известно, что серотонин имеет широкую и сложную область фармакологического действия, включая сужение кровеносных сосудов благодаря стимуляции гладкой мускулатуры и агрегации тромбоцитов. Он вызывает. [c.11]
Особенно плодотворно изотопы применяются для исследования обмена веществ. Изучаемое вещество метят (поэтому метод получил название метод меченых атомов ), вводя в него радиоактивный изотоп меченое вещество вводят в организм. После его ассимиляции исследуют присутствие меченых атомов в различных химических фракциях в организме. Концентрация вводимого в организм радиоактивного изотопа должна быть небольшой, чтобы не нарушался обмен веществ, но такой, при которой, несмотря на разведение, изотоп мог бы быть обнаружен во всех выделяемых фракциях. Например, применение СОг с меченым углеродом позволило показать широкое участие двуокиси углерода в реакциях метаболизма бактерий и тканей живого организма, расширить наши представления о механизме фотосинтеза. Изотопный метод применяется в биохимии для количественного определения аминокислот в гидролизатах белков, содержания калия, натрия и других элементов в крови, для определения общего количества воды в живом организме, объема эритроцитов и плазмы в кровотоке и т. д. [c.12]
Более надежным представляется использование условных констант, учитывающих физиологические условия. При наличии необходимой информации о константах устойчивости индивидуальных соединений, присутствующих в данной системе, можно с помощью ЭВМ оценить направление реакций, происходящих в организме. Так, применение компьютерных расчетов равновесий в растворе, содержащем одновременно ионы меди (II), цинка (II) и 22 аминокислоты, присутствующие в плазме крови [939], показало, что при рН=7,4 медь и цинк образуют смешанный комплекс с гистидином и цистеином. Таким образом, при прогнозировании результата введения в такую систему молекулы комплексона необходимо учитывать в качестве конкурирующих реакций не только образование биометаллами комплексов с аминокислотами, но и смешанно лигандных соединений. [c.493]
Присутствие свободного аммиака не мешает анализу. Метод позволяет определять пролкн и оксипролин (Downes). Однако для определения аминокислот в крови метод непригоден, так как переход окраски при титровании трудно уловим. [c.46]
R—СООН и R—NH+3 здесь являются протониро-ванными партнерами, т.е. кислотами, а R—СОО и R—NHj—сопряженными основаннямн (т.е. акцепторами протонов) соответствующих кислот. HR— СООН, и R—NH 3—это слабые кислоты, и все же R—СООН является в несколько тысяч раз более сильной кислотой, чем R—NH+j. При значениях pH, характерных для плазмы крови и межклеточной жидкости (7,4 и 7,1 соответственно), карбоксильные группы находятся исключительно в форме карбоксн-латных ионов, R—СОО . При этих значениях pH большая часть аминогрупп находится преимущественно в ассоциированной (протонированной) форме, R—NH+3. Преобладающая ионная форма аминокислот, присутствующих в крови и в большинстве тканей, представлена на рис. Ъ2,А. Структура, изображенная на рис. 3.2.Ь, не может существовать ни при каких pH. При значениях pH, достаточно низких для протонирования карбоксильной группы, аминогруппа, намного более слабая кислота, также будет протонирована. Примерные значения р/С а-карбоксильной и а-аминогрупп а-аминокислоты равны 2 и 10 соответственно (табл. 3.1). Кислота при pH ниже своего рА будет преимущественно протонирована, причем если pH будет сдвинуто на 2 единицы ниже она будет протонирована на 99%. По мере увеличения pH карбоксильная группа те- [c.22]
Химический состав опорных тканей позвоночных отличается от состава скелетных тканей беспозвоночных — спонгина, хитина и др. В покровах позвоночных присутствует особый белок - кератин. Позвоночные отличаются от беспозвоночных и действием пищерастительных ферментов, более высоким отношением (Ма + К)/ Са + Мд) в жидкой фазе внутренней среды. Среди беспозвоночных только у оболочников есть целлюлозная оболочка, имеется ванадий в крови в особых окрашенных клетках, а у круглоротых - соединительно-тканный скелет и хрящ, а также особый дыхательный пигмент — аритрокруорин с наименьшей для позвоночных молекулярной массой (17 600). Отличительная черта сипункулид — древних групп морских беспозвоночных - наличие специального переносчика кислорода - гемэритрина и наличие в эритроцитах значительного количества аллантоиновой кислоты. Для насекомых характерно высокое содержание в крови аминокислот, мочевой кислоты и редуцирующих и несбраживаемых веществ, в хитиновом покрове отсутствуют смолы, для членистоногих — наличие специфической (только для их групп) фенолазы в крови. Таким образом, можно констатировать, что систематические группы животных имеют свои биохимические особенности. Такие же особенности наблюдаются и у растений для различных систематических групп - наличие специфических белков, жиров, углеводов, алкалоидов, глюкозидов, ферментных систем. [c.189]
Аминогексановая (е-аминокапроновая) кислота применяется в медицине для остановки сильных кровотечений, так как она способствует эффективному свертыванию крови. Некоторые ее циклические аналоги (например, 4-аминометилциклогексан-карбоновая кислота) также ускоряют свертывание крови. Синтезируют е-аминокапроновую кислоту из циклогексанона через оксим, который перегруппировывают по Бекману в капролактам, а последний гидролизуют в присутствии НС1 в аминокислоту мюн [c.47]
Пептидные связи по обеим сторонам остатка аспарагиновой кислоты в молекуле белка особенно легко гидролизуются разбавленными кислотами [233], приче степень гидролиза зависит от pH раствора, а не от концентрации используемой кислоты [32, 189]. Так, из альбумина сыворотки крови быка за 18 час при 100° и pH 2,14 выделяется 44% остатков аспарагиновой кислоты в виде аминокислоты, в то время как при pH 3,15 освобождается всего 26% остатков кислоты [189]. При экстракции эластина 0,25 М щавелевой кислотой при 100° был получен растворимый белок единственной выделенной свободной аминокислотой оказалась аспарагиновая кислота [235]. Однако присутствие в продукте реакции пептидов с короткой цепью и результаты определения концевых груМп [24, 234] указывают на значительную степень гидролиза и других пептидных связей. Исследования, проведенные на модельных соединениях [73], позволили сделать вывод о лабильности связей остатков серина и треонина. Применение описанного выше метода гидролиза для исследования цепи А окисленного [c.226]
Для иодсодержащих аминокислот, важных для медицинских целей, характерен низкий уровень их нормального содержания в крови, поэтому для их разделения решено было использовать присущую ГХ чувствительность. Клинический интерес представляют шесть аминокислот моноиодтирозин, дииодтирозин, дииод-тиронин, 3,3, 5 - и 3,5,3 -трииодтиронин, а также 3,5,3, 5 -тетра-иодтиронин. Для этих соединений приняты сокращения МИТ, ДИТ, Тг, Тз, обратный Тз и Т4. Аминокислота Т4—-это тироид-ный гормон тироксин, тогда как Тз обладает аналогичной, но еще большей физиологической активностью, а обратный Тз действует как антагонист Тз и Т4. Относительно концентраций этих веществ у больных и у здоровых людей имелись различные мнения [97, 133, 134], что стимулировало поиск новых методов анализа. Присутствие иода в аминокислотах позволяет приме- [c.92]
Следует отметить, что фермент, катализирующий окислительное декарбоксилирование указанных а-кетокислот, высокоспецифичен (по аналогии с пируватдегидрогеназным и а-кетоглутаратдегидрогеназным комплексами) и также нуждается в присутствии всех пяти кофакторов (см. главу 10). Известно наследственное заболевание болезнь кленового сиропа , при которой нарушено декарбоксилирование указанных а-кетокислот (вследствие синтеза дефектного дегидрогеназного комплекса), что приводит не только к накоплению в крови аминокислот и а-кетокислот, но и к их экскреции с мочой, издающей запах кленового сиропа. Болезнь встречается редко, проявляется обычно в раннем детском возрасте и приводит к нарушению функции мозга и летальному исходу, если не ограничить или полностью не исключить поступление с пищей лейцина, изолейцина и валина. [c.459]
Применение всех перечисленных приемов позволило определить природу связи между углеводной и пептидной частью в нескольких гликопротеинах. В настоящее время твердо установлено наличие О-гликозидной связи через оксиаминокислоты (тип Р) для муцинов подчелюстных желез, групповых веществ крови, комплекса гепарина с белком и др. и N-aцил-гликозиламинной связи через аспарагиновую и, вероятно, глутаминовую кислоту (тип Е) для овальбумина, орозомукоида и других гликопротеинов. Знаменательно, что для образования указанных гликопептидных связей необходимо присутствие специфических аминокислот — оксиаминокислот и двухосновных кислот, которые обязательно входят в состав природных гликопротеинов в количествах, иногда значительно превышающих их содержание в обычных белках. [c.573]
Инсулин — белково-пептидный гормон, вырабатываемый островками поджелудочной железы. Является регулятором углеводного обмена в органиа-ме — стимулирует усвоение глюкозы и ее превращение в гликоген, при введении в организм понижает содержание сахара в крови. Молекула инсулина включает не менее 707 атомов и состоит из двух пептидных цепей, включающих 21 и 30 остатков аминокислот, цепи соединены двумя мостиками —8—5—, а один дисульфидный мостик имеется в более короткой цепи. Молекулы инсулина склонны к агрегации (с обраэованц от димеров до гексамеров) в присутствии ионов 2п +. Инсулин — первый белок, строение которого было расшифровано и воспроизведено в лаборатории. Используется для лечения диабета (сахарной болезни), [c.557]
Р-Нафтохинон-4-сульфокислота, применявшаяся Фолиным [98, 99] для анализа аминокислот в моче и крови, обладает умеренной реакционной способностью [100]. При реакции с аминогруппой желтая окраска, свойственная реагенту, очищенному по методу Фолина [98], переходит в желтовато-коричневую. В ходе реакции происходит арилирование аминогруппы с отщеплением сульфогруппы реагента. Определение проводят в несколько стадий [100] вначале инкубируют без доступа света реакционную смесь, включающую раствор белка, бикарбонатный буфер (pH 8,8), диоксан и раствор НХС в 50%-ном метаноле, а затем добавляют уксусную кислоту и диоксан. Далее определяют разницу в величине поглощения при 480 нм рабочего и контрольного раствора, не содержащего белка Аб48о = 3800 М см Ч При инкубации контрольный раствор приобретает интенсивную окраску, однако он почти полностью обесцвечивается при последующем подкислении уксусной кислотой. Окраска, свойственная производным по аминогруппе, не исчезает при подкислении. Присутствие диоксана до и после подкисления предотвращает осаждение модифицированного белка. В табл. 3 сопоставлены результаты модификации аминогрупп ряда белков с помощью НХС и некоторых других реагентов. [c.360]
Иммунная система противодействует заболеванию организма и вторжению в него посторонних веществ. За последние 20 лет многое стало известным о группе ферментов и других белков, которые фиксируют присутствие инородного тела и координируют ответную реакцию организма. Клетки плазмы, продуцируемые белыми кровяными тельцами, выделяют в кровь молекулы антитела. Антитела нейтрализуют чужеродные белки или присутствующие в крови полисахариды, способные вызвать заболевание. Химикам принадлежит решающий вклад в изучение природы молекул антител. Именно химики первыми продемонстрировали, что это белки, а затем определили их действительное химическое строение, а также структуру кодируюпщх их генов. В результате стали проясняться детали созданной природой системы. Антитела содержат переменную (вариабельную) область, в которой последовательность аминокислот меняется в зависимости от того, какое инородное вещество надо нейтрализовать, и постоянную (константную) область, которая в основном одинакова в большинстве антител. Переменная область молекулы распознает и связывает специфические тела вторжения, а постоянная занимается собственно устранением постороннего вещества. Полученные результаты открывают широкие возможности для дальнейших исследований. Настоятельная необходимость самых интенсивных исследований в этой области усугубляется необходимостью разработки эффективного лечения синдрома приобретенного иммунодефицита (СПИД). [c.107]
При обработке гемоглобина разведенными минеральными кислотами или щелочами получается г е м а т и н, представляющий собой окисленную форму гема и содержащий Ре . При восстановлении гематина, например, сернистым аммонием в присутствии глобина получается гемохромоген — пигмент с очень характерным спектром поглощения, который представляет собой соединение денатурированного глобина с гемом. При судебномедицинских исследованиях кровяных пятен для доказательства на личия крови гемоглобин обычно переводят именно в форму гемохромогена так как последний может быть открыт спектроскопическим путем в самых минимальных концентрациях. В недавнее время было предложено терми ном гемохромогены называть самые различные соединения гема с азоти стыми веществами, в том числе с аминокислотами, пиридином, никотином гидразином и другими соединениями. С этой точки зрения гемоглобиь представляет собой лишь один из гемохромогенов. Соответствующие сое динения с гематином называются парагематинами. Соединение гематина с денатурированным глобином — прежний глобин-Парагематин — получило специальное название катгемоглобина. Соотношения между всеми упомянутыми дериватами гемоглобина могут быть представлены следующей схемой [c.64]
АЛЬБУМИНЫ — простейшие представители природных белков, присутствующие во всех растит, и животных тканях в отличие от глобулинов, с к-рыми они составляют группу растворимых белков, растворяются в гюлунасыщенном (50% насыщения) р-ре сернокислого аммония и в дистиллированной воде. Изоэлоктрич. точка А. в пределах pH 4,6—4,8 мол. в. не превышает 75 ООО. Вое А. — глобулярные белки. А. способны к образованию хорошо оформленных кристаллов в электрофоретич. поле А., как правило, могут быть ра.зде.лены на 2 и более комнонептов. А. растворимы в к-тах, щелочах, при нагревании свертываются нри гидролизе образуют различные аминокислоты, для состава к-рых характерно отсутствие или относи 1 ельно низкое содержание глицина (не более 2%). А. богаты серусодержащими и дикарбоно-выми аминокис.потами. В живых тканях А. обычно находятся в виде соединений с липидами, углеводами и др. белками содержатся в белке яиц, сыворотке крови, мо,локе, семенах растений. А. получают из плазмы крови фракционир, осаждением при пизких темп-рах этот препарат широко применяют в медицинской практике, особенно для питания, путем введения в кровь. Кроме того. А, получают также из крови животных (сывороточный А.), отделением белка яиц от желтка (яичный А.), а также из молочной сыворотки при нагревании до 75° (молочный А.). А. применяются в фармацевтич., кондитерской, текстильной и др. отраслях промышленности и для осветления вии. [c.68]
Интересны данные о содержании аминокислот в плазме крови человека [326]. Главным аминокислотным компонентом плазмы является глутамин на его долю приходится около Д всего содержания аминокислот. Глутаминовая и аспарагиновая кислоты присутствуют в плазме в сравнительно небольшом количестве. Содержание аланина, валина, пролина и лизина выше, чем остальных аминокислот. Наконец, заслуживает внимания наличие в плазме аспарагина, орнитина, цитруллина и таурина. [c.63]
Источником его образования является аминокислота триптофан. Небольшие количества серотонина постоянно присутствуют в крови, где он может быть обнаружен флюоро-скопически. [c.211]
П. — сложный белок — гликопротеид, мол. в. 108 000—127 ООО, в состав к-рого, помимо аминокислот, входит до 1,5% гексоз. П. растворим в воде при pH ниже 5 и выше 9 плохо растворим при средних значениях pH. Ирп pH 2, 3—3,0 водные р-ры П. весьма устойчивы, в нейтральных р-рах П. подвергается быстрому самопсревариванию (см. Аутолиз). В крови животных и человека П. находится в форме неактивного предшественника и л а з м и н о г е п а (и р о-ф и б р и н о л и 3 и н а), к-рый под действием ряда факторов, присутствующих в крови и различных тканях, превращается в П. В частности, превращение плазминогена в II. катализируется самим Н. (автокатализ), а также трипсином и уроки на- [c.22]
Согласно взглядам Гауровица [13], матрица, которая благодаря присутствию молекулы антигена зеркально отражает характерные участки этого антигена, удерживается в развернутом состоянии полярными силами молекулы нуклеиновой кислоты. Матрица притягивает к себе молекулы аминокислот, из которых и строится новый отпечаток, затем поступающий в кровь. Согласно этой теории, для образования антител достаточно присутствия небольшого количества антигена, хотя, строго говоря, возможно, это и не является обязательной частью теории. [c.41]
В кристаллическом виде впервые выделена О. Варбургом и В. Христианом в 1943 г. из мышц крысы. Фермент найден практически во всех живых объектах, присутствует, как правило, в растворимой фракции цитоплазмы, в мозгу обнаружен в митохондриях, небольшое его количество найдено в сыворотке крови. Мышечный фермент расщепляет ряд различных кетозо-1-фосфатов. Фермент высокоспецифичен по отношению к диоксиацетонфосфату, мол. масса равна 147—180 ООО, ссктоит из четырех субъединиц. В кислой среде он диссоциирует на неактивные субъединицы при нейтрализации среды субъединицы легко и самопроизвольно воссоединяются, образуя активный фермент. Изоэлектрическая точка находятся при pH 6,05. Аминокислотный анализ показал наличие всех известных аминокислот. [c.94]
chem21.info