Тироксин - гормон щитовидной железы. После частичного превращения в трийодтиронин (в печени и почках) и перехода в клетки организма, оказывает влияние на развитие и рост тканей, на обмен веществ. В малых дозах оказывает анаболическое действие на белковый и жировой обмен. В средних дозах стимулирует рост и развитие, повышает потребность тканей в кислороде, стимулирует метаболизм белков, жиров и углеводов, повышает функциональную активность сердечно-сосудистой системы и центральной нервной системы. В больших дозах угнетает выработку тиротропин-рилизинг гормона гипоталамуса и тиреотропного гормона гипофиза. Тироксин влияет на обмен веществ, развитие тканей, в небольших дозах проявляет себя как анаболик (помогает увеличивать мышечный объем), в средних дозах активизирует жировой, белковый, углеводный обмен, положительно сказывается на состоянии нервной системы, сосудов, сердца.
Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса. Гипотиреоз у новорождённых приводит к развитию кретинизма, который проявляется множественными врождёнными нарушениями и тяжёлой необратимой задержкой умственного развития. Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином "микседема". Отёчность обусловлена избыточным накоплением гликозаминогликанов и воды. В подкожной клетчатке накапливается глюкуроновая и в меньшей степени хондроитинсерная кислоты. Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции. В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото).
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2-5 раз и развитие тиреотоксикоза. Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит) , потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодер-жащих препаратов, аутоиммунные реакции. В большей мере усиливаются процессы катаболизма, о чём свидетельствует отрицательный азотистый баланс.
Жиры, как и гликоген, являются формами депонирования энергетического материала. Причем жиры — наиболее долговременные и более эффективные источники энергии. При голодании запасы жира у человека истощаются за 5—7 недель, тогда как гликоген полностью расходуется примерно за сутки. Если поступление жира превышает потребности организма в энергии , то жир депонируется в адипоцитах — специализированных клетках жировой ткани. Кроме того, если количество поступающих углеводов больше, чем надо для депонирования в виде гликогена, то часть глюкозы также превращается в жиры . Таким образом, жиры в жировой ткани накапливаются в результате трех процессов:
поступают из хиломикронов, которые приносят экзогенные жиры из кишечника
поступают из ЛОНП, которые транспортируют эндогенные жиры, синтезированные в печени из глюкозы
образуются из глюкозы в самих клетках жировой ткани.
В первом и во втором случае жиры в составе липопротеинов гидролизуются ЛП—липазой и в клетку поступают жирные кислоты, которые затем используются для синтеза ТАГ. Перед включением в ТАГ жирные кислоты сначала активируются путем образования тиоэфиров кофермента А, а затем взаимодействуют с глицеролфосфатом. Следовательно, синтез ТАГ может протекать только в присутствии глюкозы, из которой в процессе гликолиза образуется диаксиацетонфосфат. Инсулин стимулирует синтез ТАГ, потому что в его присутствии повышается проницаемость мембран клеток жировой ткани для глюкозы.
Билет 19
Биосинтез проколлагена и его превращение в коллаген. Фибриллогенез. Возможные нарушения.
Проколлаген - внутриклеточный предшественник коллагена, синтезируемый на полирибосомах, связанных с мембранами эндоплазматической сети.
Синтез и созревание коллагена – многоэтапный процесс, начинающийся в клетке и завершающийся в межклеточном матриксе. Включает в себя целый ряд посттрансляционных изменений: гидроксилирование пролина и лизина с образованием гидроксипролина и гидроксилизина; гликозилирование гидроксилизина; частичный протеолиз – отщепление «сигнального» пептида, а также N- и С – концевых пропептидов; образование тройной спирали.
Синтез полипептидный цепей коллагена.
Синтезируются на полирибосомах, связанных с мембранами ЭР, в виде более длинных, чем зрелые цепи, предшественников – препро – α – цепей.
Эти предшественники имеют гидрофобный «сигнальный» пептид на N – конце, содержащий около 100 аминокислот.
Функция сигнального пептида – ориентация синтеза пептидных цепей в полости ЭР. После выполнения функции – отщепляется.
Синтезированная молекула проколлагена содержит дополнительные участки – N- и С - концевые пропептиды, в составе которых остатки цистеина, образующие внутри- и межцепочечные S-S связи.
Посттрансляционные модификации коллагена.
Начинается в период трансляции коллагеновой мРНК на рибосомах
Продолжается на растущей полипептидной цепи вплоть до отделения от рибосом.
После образования тройной спирали дальнейшее гидроксилирование пролиновых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют оксигеназы, связанные с мембранами микросом.
Пролиловые и лизиловые остатки в Y – положении пептида подвергаются действию пролил-4-гидроксилазы и лизил-5-гидроксилазы.
Необходимые компоненты – α – кетоглутарат, кислород и витамин С.
Донор атома кислорода, присоединяющегося к С – 4 пролина, - молекула кислорода.
Гидроксилазы пролина и лизина содержат в активном центре атом железа II. Для сохранения атома железа в ферроформе необходим восстанавливающий агент, роль которого выполняет аскорбиновая кислота, легко окисляющаяся в дегидроаскорбиновую кислоту.
После завершения гидроксилирования при участии гидроксилтрансфераз в состав молекулы проколлагена вводятся углеводные группы – галактоза, дисахарид галактозилглюкоза.
Образуют ковалентную О – гликозидную связь с 5-ОН-группой гидроксилизина.
Гликозилирование происходит в коллагене, езё не претерпевшем спирализации
Завершается после образования тройной спирали
Каждая про – α – цепь соединяется водородными связями с двумя другими про – α – цепями, образуя тройную спираль проколлагена.
Происходит ещё в просвете ЭР и начинаются после образования межцепочечных дисульфидных мостиков в области С – концевых пропептидов.
Из ЭР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
В межклеточной матриксе концевые пропептиды коллагенов I, II, III типов отщепляются специфическими проколлагенпептидазами
Образуются молекулы тропоколлагена – структурные единицы коллагеновых фибрилл.
Снижение активности ферментов (синдром Элерса – Данло – Русакова, тип VII) концевые пропептиды проколлагена не отщепляются и нарушается образование тропоколлагена и образование нормальный коллагеновых фибрилл.
Клинически – малый рост, искривление позвоночника, привычные вывихи суставов, высокая растяжимость кожи.
Переваривание белков и всасывание аминокислот. Биологическая ценность белков. Механизм транспорта аминокислот через клеточную мембрану. Роль ГГТП.
Химус поступает в 12пк. Низкое значение рН химуса вызывает в кишечнике выделение секретина, поступающего в кровь. Он стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации HCl желудочного сока и ингибированию пепсина, вследствие чего возрастает рН резко от 1,5 – 2,0 до 7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого гормона – холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом 7,5 – 8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Активация трипсиногена: под действием энтеропептидазы. Она отщепляет с N – конца молекулы трипсиногена гексапептид Вал – (Асп)4 – Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, образуется активный трипсин.
Образовавшийся трипсин активирует химотрипсиноген, из которого образуется несколько активных ферментов.
Под действием трипсина расщепляется пептидная связь между 15 и 16 аминокислотами, в результате чего образуется активный π – химотрипсин. Затем под действием π – химотрипсина отщепляется депиптид сер(14)-арг(15), что приводит к образованию δ – химотрипсина. Отщепление дипептида тре(147) – арг(148) завершает образование стабильной формы активного фермента – α – химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками.
Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного пртеолиза. В результате образуются ферменты – эластаза и карбоксипептидаза А и В.
Трипсин гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина.
Химотрипсины активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (фен, тир, три).
Карбоксипептидазы А и В – цинкосодержащие ферменты, отщепляют С – концевые остатки аминокислот. КП А отщепляет аминокислоты с ароматическими или гидрофобными радикалами, а КП В – остатки аргинина и лизина.
Последний этап переваривания – гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Транспорт двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной проток.
Всасывание L – аминокислот (не D – изомеров) – активный транспорт, с затратами энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь.
Перенос через щёточную каёмку переносчиками, многие из которых работают при участии Na – зависимых механизмав симпорта, подобно переносу глюкозы.
Механизм всасывания аминокислот в кишечнике: L – аминокислота поступает в энтероцит симпортом с ионом Na. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично – активного транспорта с помощью Na/K – АТФ-азы.
Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, полчках и, по-видимому, мозге. Эта система – γ – глутамильный цикл.
В ней участвует 6 ферментов, один из которых находится в клеточной мембране, остальные – в цитозоле.
Ключевая роль в транспорте аминокислот принадлежит ферменту γ – глутамилтрансферазе – гликопротеин, катализирует перенос γ – глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку.
Аминокислота, связанная с γ – глутамильным остатком, оказывается внутри клетки. Происходит отщепление γ – глутамильного остатка под действием фермента γ – глутамилциклотрансферазы.
Дипептид цистеинглицин расщепляется под действием пептидазы на 2 аминокислоты – цистеин и глицин.
Следующие три реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно.
Для транспорта в клетку одной аминокислоты с участием γ – глутамильного цикла затрачивается 3 молекулы АТФ.
Азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (в виде мочевины и аммонийных солей). Азотистое равновесие – поступающий азот равен выделяемому. Положительный баланс - поступает больше, чем выводится. Отрицательный – выделяется больше, чем поступает. Минимальное количество белков, необходимое для поддержания азотистого равновесия = 30 – 50 г/сут, оптимальное количество при средней физической нагрузке = 100-120 г/сут.
Полноценность в питании: Незаменимые аминокислоты – те, синтез которых сложен и неэкономичен для организма. Их выгоднее получать с пищей. Это - фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин. Аргинин и гистидин – заменимые – необходимо дополнительное их поступление в организм с пищей, особенно детям. К ним также относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серин, пролин, аланин. Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмам.
Норма белка в питании: принятые нормы белкового питания для взрослых и детей учитывают климатические условия, профессию, условия труда и др. Взрослый человек при средней физической нагрузке должен получать 100-120 г белка в сутки. При тяжёлой нагрузке – 130-150г. Детям до 12 лет достаточно 50-70 г белка в сутки. При этом подразумевается, что в пищу входят разнообразные белки животного и растительного происхождения.
Перед вами двое больных с анемией. У одного - дефицит витамина В6, у другого – В12. Какие исследования следует провести, чтобы отдифференцировать эти состояния? Как изменятся их результаты?
При дефиците В12 из-за разрушения в красном костном мозге мегалобластов будет повышен уровень билирубина. При дефиците В6, т.к. он является коферментом синтеза гема, будет снижено количество гемоглобина.
Билет 20.
Посттранскрипционный процессинг. Основные этапы. Значение. Регуляция биосинтеза белка на уровне транскрипции.
Первичные транскрипты мРНК, прежде чем будут использованы в ходе синтеза белка, подвергаются ряду вокалентной модификации. Эти модификации необходимы для функционирования мРНК в качестве матрицы.
Модификация 5’ – конца.
Начинается на стадии элонгации.
Когда длина первичного транскрипта достигает примерно 30 нуклеотидных остатков, происходит кэпирование его 5’ – конца гуанилилтрансферазой, которая гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5’ – фосфатной группой к 5’ – концу синтезированного фрагмента РНК с образованием 5’, 5’ – фосфодиэфирной связи.
Последующее метилирование остатка гуанина в составе ГТФ с образование N7-метилгуанозина завершает формирование кэпа.
Модифицированные 5’ – конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5’ – экзонуклеаз в цитоплазме.
Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также нужно для работы сложной ферментной системы, обеспечивающей удаление интронов.
3’ – конец транскриптов, синтезированных РНК – полимеразой II, также подвергаются модификациям, при которых специальным ферментом полиА – полимеразой формируется полиА – последовательность (полиА – «хвост»), состоящая из 100-200 остатков адениловой кислоты.
Сигнал к началу полиаденилирования – последовательность –AAUAAA- на растущей цепи РНК
К 3’ – концу в точке разрыва полиА – полимераза наращивает полиА – «хвост». Наличие полиА – последовательности на 3’ – конце облегчает выход мРНК из ядра и замедляет её годролиз в цитоплазме.
Последовательности нуклеотидов, присутствующие в ДНК, но не входящие в состав зрелой мРНК – интроны, а последовательности, присутствующие в мРНК, - кодирующие, или экзоны.
Первичный транскрипт – строго комплементарная матрице нуклеиновая кислота (пре – мРНК), содержащая как экзоны, так и интроны. Длина – от 80 до 1000 нуклеотидов.
Последовательности интронов «вырезаются» из первичного транскрипта, концы экзонов соединяются друг с другом. Такая модификация РНК – сплайсинг. Происходит в ядре, в цитоплазму поступает уже «зрелая» мРРНРНК.
Процесс «вырезания» интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП), в состав которых входит малая ядерная РНК, нуклеотидная цепь которой связана с белковым остовом, состоящим из нескольких протомеров.
первичный транскрипт тРНК содержит около 100 нуклеотидов, а после процессинга – 70-90 нуклеотидных остатков.
Происходят при участии РНК-аз (рибонуклеаз).
Формирование 3’ – конца тРНК катализирует РНК-аза, представляющая собой 3’ – экзонуклеазу, «отрезающую» по одному нуклеотиду, пока не достигает последовательности
-ССА, одинаковой для всех тРНК.
Пре – тРНК содержит всего один интрон, состоящий из 14-16 нуклеотидов. Удаление интрона и сплайсинг приводят к формированию структуры, называемой «антикодон» - триплета нуклеотидов, обеспечивающего взаимодействие тРНК с комплементарным кодоном мРНК в ходе синтеза белков.
Гены рРНК транскрибируются РНК – полимеразой I с образованием идентичных транскриптов. Первичные транскрипты имеют длину около 13000 нуклеотидных остатков (45S рРНК).
Прежде чем покинуть ядро в составе рибосомной частицы, молекула 45S рРНК подвергается процессингу, в результате образуется 28S рРНК (около 2000 нуклеотидов) и 5,8S рРНК (около 160 нуклеотидов), которые являются компонентами рибосом. Остальная часть транскрипта разрушается в ядре.
Рибосома – органелла клетки, участвующая в биосинтезе белка. Рибосома эукариотов состоят из двух, большой и малой, субъединиц: 60S и 40S. Белки рибосом выполняют структурную, регуляторную и каталитическую функции.
Транскрипция – первая стадия реализации генетической информации в клетке. В ходе процессинга образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции.
Происходит в ядре. ДНК служит только матрицей и в ходе транскрипции не изменяется.
Рибонуклеозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) – субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования 3’, 5’ – фосфодиэфирной связи между рибонуклеозидмонофосфатами.
Синтез РНК начинается в определённых последовательностях (сайтах) ДНК – промоторах, и завершается в терминирующих участках (сайты терминации).
Участок ДНК, ограниченный прогмотором и сайтом терминации – единица транскрипции – транскрипт.
Транскрипционные факторы – белки, взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транскриптонах = 1:9(эукариоты).
Биосинтез РНК осуществляется ДНК – зависимыми РНК – полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК – полимеразы: РНК – полимераза I, синтезирующая пре – рРНК, РНк – полимераза II, синтезирующая пре – мРНК, РНК – полимераза III – синтезирующая пре – тРНК.
РНК – полимеразы – олигомерные ферменты, состоящие из нескольких субъединиц - 2α, β, β’, σ. Субъединица σ выполняет регуляторну. Функцию, это один из факторов инициации транскрипции.
РНК – полимеразы I, II, III, узнающие разные промоторв, содержат разные по стороению субъединицы σ.
Инициации. Характеризуется активацией промотора с помощью белка – ТАТА – фактора. Его присоединение облегчает взаимодействие промотора с РНК – полимеразой. Образуется транскрипционная вилка.
Элонгация. Её факторы повышают активность РНК – полимеразы и облегчают расхождение цепей ДНК. Синтез РНК идёт от 5’- к 3’ – концу комплементарно матричной цепи ДНК.
Терминация. Раскручивание двойной спирали ДНК в области терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определённых участках матрицы – терминаторах (сайты терминации). Фактор терминации облегчает отделение первичного транскрипта (пре – мРНК), комплементарного матрице, и РНК – полимеразы от матрицы. РНК – полимераза может вступить в следующийц цикл транскрипции после присоединения субъединицы σ.
Образование кетоновых тел. Биологическая роль процесса. Причины и последствия кетоза.
В печени часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы. К кетоновым телам относят β – гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел.
При низком соотношении инсулин – глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большом количестве, чем в норме. Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для ГНГ. В результате скорость образования ацетил – КоА превышает способность ЦТК окислять его. Ацетил – КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез начинается с взаимодействия двух молекул ацетил – КоА, которые под действием фермента тиолазы образуют ацетоацетил – КоА. С ним взаимодействует третья молекула ацетил – КоА, образуя 3-гидрокси – 3 – метилглутарил – КоА (ГМГ – КоА). Эту реакцию катализирует расщепление ГМГ – КоА на свободный ацетоацетат и ацетил – КоА.
Ацетоацетат может выделяться в кровь или превращаться в печени в β – гидроксибутират восстановлением.
При активном β – окислении создается высокая концентрация НАДН, что способствует превращению большей части ацетоацетата в β – гидроксибутират. Именно он свляется основным кетоновым телом. При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью.
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и мочой. Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.
Регуляция синтеза: ГМГ – КоА – синтаза. 1) индуцируемый фермент, его синтез увеличивается при повышении концентрации жирных кислот в крови. Это происходит при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или нагрузке. 2) ингибируется высокими концентрациями свободного кофермента А. 3) когда поступление жирных кислот в клетки увеличивается, КоА связывается с ними, концентрация свободного КоА снижается, и фермент становится активным. 4) если поступление жирных кислот в клетки печени уменьшается, то увеличивается концентрация свободного КоА, ингибирующего фермент. Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Синтез кетоновых тел в периферических тканях. Рисунок 8-34.
Кетоацидоз. В норме концентрация кетоновых тел в крови = 1-3мг/мл. Увеличение кетоновых тел в крови - кетонемия, выделение с мочой – кетонурия. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсаторному ацидозу), а в тяжёлых случаях – к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) – водорастворимые органические кислоты, способные к диссоциации: СН3-СО-СН2-СООН <-> СН3-СО-СН2-СОО+Н.
Назначьте биохимическое обследование больному с подозрением на поражение поджелудочной железы.
Проверить активность пищеварительных ферментов поджелудочной железы – амилазы, панкреатической липазы, химотрипсина и трипсина.
Билет 21
studfiles.net
Тироксин - гормон щитовидной железы. После частичного превращения в трийодтиронин (в печени и почках) и перехода в клетки организма, оказывает влияние на развитие и рост тканей, на обмен веществ. В малых дозах оказывает анаболическое действие на белковый и жировой обмен. В средних дозах стимулирует рост и развитие, повышает потребность тканей в кислороде, стимулирует метаболизм белков, жиров и углеводов, повышает функциональную активность сердечно-сосудистой системы и центральной нервной системы. В больших дозах угнетает выработку тиротропин-рилизинг гормона гипоталамуса и тиреотропного гормона гипофиза. Тироксин влияет на обмен веществ, развитие тканей, в небольших дозах проявляет себя как анаболик (помогает увеличивать мышечный объем), в средних дозах активизирует жировой, белковый, углеводный обмен, положительно сказывается на состоянии нервной системы, сосудов, сердца.
Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса. Гипотиреоз у новорождённых приводит к развитию кретинизма, который проявляется множественными врождёнными нарушениями и тяжёлой необратимой задержкой умственного развития. Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином "микседема". Отёчность обусловлена избыточным накоплением гликозаминогликанов и воды. В подкожной клетчатке накапливается глюкуроновая и в меньшей степени хондроитинсерная кислоты. Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции. В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото).
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2-5 раз и развитие тиреотоксикоза. Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит) , потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодер-жащих препаратов, аутоиммунные реакции. В большей мере усиливаются процессы катаболизма, о чём свидетельствует отрицательный азотистый баланс.
В составе хиломикронов экзогенные жиры доставляются в органы и ткани. Липопротеинлипаза (ЛП—липаза) — фермент, обеспечивающий потребление экзогенных жиров тканями. ЛП—липаза, располагающаяся в эндотелии сосудов, взаимодействует с хиломикронами кровотока и гидролизует триацилглирины на глицерин и жирные кислоты, которые поступают в клетку. По мере извлечения ТАГ из хиломикронов последние превращаются в остаточные хиломикроны и затем поступают в печень.
Жиры, как и гликоген, являются формами депонирования энергетического материала. Причем жиры — наиболее долговременные и более эффективные источники энергии. При голодании запасы жира у человека истощаются за 5—7 недель, тогда как гликоген полностью расходуется примерно за сутки. Если поступление жира превышает потребности организма в энергии , то жир депонируется в адипоцитах — специализированных клетках жировой ткани. Кроме того, если количество поступающих углеводов больше, чем надо для депонирования в виде гликогена, то часть глюкозы также превращается в жиры . Таким образом, жиры в жировой ткани накапливаются в результате трех процессов:
поступают из хиломикронов, которые приносят экзогенные жиры из кишечника
поступают из ЛОНП, которые транспортируют эндогенные жиры, синтезированные в печени из глюкозы
образуются из глюкозы в самих клетках жировой ткани.
В первом и во втором случае жиры в составе липопротеинов гидролизуются ЛП—липазой и в клетку поступают жирные кислоты, которые затем используются для синтеза ТАГ. Перед включением в ТАГ жирные кислоты сначала активируются путем образования тиоэфиров кофермента А, а затем взаимодействуют с глицеролфосфатом. Следовательно, синтез ТАГ может протекать только в присутствии глюкозы, из которой в процессе гликолиза образуется диаксиацетонфосфат. Инсулин стимулирует синтез ТАГ, потому что в его присутствии повышается проницаемость мембран клеток жировой ткани для глюкозы.
Билет 19
Биосинтез проколлагена и его превращение в коллаген. Фибриллогенез. Возможные нарушения.
Проколлаген - внутриклеточный предшественник коллагена, синтезируемый на полирибосомах, связанных с мембранами эндоплазматической сети.
Синтез и созревание коллагена – многоэтапный процесс, начинающийся в клетке и завершающийся в межклеточном матриксе. Включает в себя целый ряд посттрансляционных изменений: гидроксилирование пролина и лизина с образованием гидроксипролина и гидроксилизина; гликозилирование гидроксилизина; частичный протеолиз – отщепление «сигнального» пептида, а также N- и С – концевых пропептидов; образование тройной спирали.
Синтез полипептидный цепей коллагена.
Синтезируются на полирибосомах, связанных с мембранами ЭР, в виде более длинных, чем зрелые цепи, предшественников – препро – α – цепей.
Эти предшественники имеют гидрофобный «сигнальный» пептид на N – конце, содержащий около 100 аминокислот.
Функция сигнального пептида – ориентация синтеза пептидных цепей в полости ЭР. После выполнения функции – отщепляется.
Синтезированная молекула проколлагена содержит дополнительные участки – N- и С - концевые пропептиды, в составе которых остатки цистеина, образующие внутри- и межцепочечные S-S связи.
Посттрансляционные модификации коллагена.
Начинается в период трансляции коллагеновой мРНК на рибосомах
Продолжается на растущей полипептидной цепи вплоть до отделения от рибосом.
После образования тройной спирали дальнейшее гидроксилирование пролиновых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют оксигеназы, связанные с мембранами микросом.
Пролиловые и лизиловые остатки в Y – положении пептида подвергаются действию пролил-4-гидроксилазы и лизил-5-гидроксилазы.
Необходимые компоненты – α – кетоглутарат, кислород и витамин С.
Донор атома кислорода, присоединяющегося к С – 4 пролина, - молекула кислорода.
Гидроксилазы пролина и лизина содержат в активном центре атом железа II. Для сохранения атома железа в ферроформе необходим восстанавливающий агент, роль которого выполняет аскорбиновая кислота, легко окисляющаяся в дегидроаскорбиновую кислоту.
После завершения гидроксилирования при участии гидроксилтрансфераз в состав молекулы проколлагена вводятся углеводные группы – галактоза, дисахарид галактозилглюкоза.
Образуют ковалентную О – гликозидную связь с 5-ОН-группой гидроксилизина.
Гликозилирование происходит в коллагене, езё не претерпевшем спирализации
Завершается после образования тройной спирали
Каждая про – α – цепь соединяется водородными связями с двумя другими про – α – цепями, образуя тройную спираль проколлагена.
Происходит ещё в просвете ЭР и начинаются после образования межцепочечных дисульфидных мостиков в области С – концевых пропептидов.
Из ЭР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
В межклеточной матриксе концевые пропептиды коллагенов I, II, III типов отщепляются специфическими проколлагенпептидазами
Образуются молекулы тропоколлагена – структурные единицы коллагеновых фибрилл.
Снижение активности ферментов (синдром Элерса – Данло – Русакова, тип VII) концевые пропептиды проколлагена не отщепляются и нарушается образование тропоколлагена и образование нормальный коллагеновых фибрилл.
Клинически – малый рост, искривление позвоночника, привычные вывихи суставов, высокая растяжимость кожи.
Переваривание белков и всасывание аминокислот. Биологическая ценность белков. Механизм транспорта аминокислот через клеточную мембрану. Роль ГГТП.
Химус поступает в 12пк. Низкое значение рН химуса вызывает в кишечнике выделение секретина, поступающего в кровь. Он стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации HCl желудочного сока и ингибированию пепсина, вследствие чего возрастает рН резко от 1,5 – 2,0 до 7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого гормона – холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом 7,5 – 8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Активация трипсиногена: под действием энтеропептидазы. Она отщепляет с N – конца молекулы трипсиногена гексапептид Вал – (Асп)4 – Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, образуется активный трипсин.
Образовавшийся трипсин активирует химотрипсиноген, из которого образуется несколько активных ферментов.
Под действием трипсина расщепляется пептидная связь между 15 и 16 аминокислотами, в результате чего образуется активный π – химотрипсин. Затем под действием π – химотрипсина отщепляется депиптид сер(14)-арг(15), что приводит к образованию δ – химотрипсина. Отщепление дипептида тре(147) – арг(148) завершает образование стабильной формы активного фермента – α – химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками.
Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного пртеолиза. В результате образуются ферменты – эластаза и карбоксипептидаза А и В.
Трипсин гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина.
Химотрипсины активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (фен, тир, три).
Карбоксипептидазы А и В – цинкосодержащие ферменты, отщепляют С – концевые остатки аминокислот. КП А отщепляет аминокислоты с ароматическими или гидрофобными радикалами, а КП В – остатки аргинина и лизина.
Последний этап переваривания – гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Транспорт двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной проток.
Всасывание L – аминокислот (не D – изомеров) – активный транспорт, с затратами энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь.
Перенос через щёточную каёмку переносчиками, многие из которых работают при участии Na – зависимых механизмав симпорта, подобно переносу глюкозы.
Механизм всасывания аминокислот в кишечнике: L – аминокислота поступает в энтероцит симпортом с ионом Na. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично – активного транспорта с помощью Na/K – АТФ-азы.
Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, полчках и, по-видимому, мозге. Эта система – γ – глутамильный цикл.
В ней участвует 6 ферментов, один из которых находится в клеточной мембране, остальные – в цитозоле.
Ключевая роль в транспорте аминокислот принадлежит ферменту γ – глутамилтрансферазе – гликопротеин, катализирует перенос γ – глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку.
Аминокислота, связанная с γ – глутамильным остатком, оказывается внутри клетки. Происходит отщепление γ – глутамильного остатка под действием фермента γ – глутамилциклотрансферазы.
Дипептид цистеинглицин расщепляется под действием пептидазы на 2 аминокислоты – цистеин и глицин.
В результате - перенос одной молекулы аминокислоты в клетку (внутриклеточную структуру).
Следующие три реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно.
Для транспорта в клетку одной аминокислоты с участием γ – глутамильного цикла затрачивается 3 молекулы АТФ.
Азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (в виде мочевины и аммонийных солей). Азотистое равновесие – поступающий азот равен выделяемому. Положительный баланс - поступает больше, чем выводится. Отрицательный – выделяется больше, чем поступает. Минимальное количество белков, необходимое для поддержания азотистого равновесия = 30 – 50 г/сут, оптимальное количество при средней физической нагрузке = 100-120 г/сут.
Полноценность в питании: Незаменимые аминокислоты – те, синтез которых сложен и неэкономичен для организма. Их выгоднее получать с пищей. Это - фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин. Аргинин и гистидин – заменимые – необходимо дополнительное их поступление в организм с пищей, особенно детям. К ним также относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серин, пролин, аланин. Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмам.
Норма белка в питании: принятые нормы белкового питания для взрослых и детей учитывают климатические условия, профессию, условия труда и др. Взрослый человек при средней физической нагрузке должен получать 100-120 г белка в сутки. При тяжёлой нагрузке – 130-150г. Детям до 12 лет достаточно 50-70 г белка в сутки. При этом подразумевается, что в пищу входят разнообразные белки животного и растительного происхождения.
Перед вами двое больных с анемией. У одного - дефицит витамина В6, у другого – В12. Какие исследования следует провести, чтобы отдифференцировать эти состояния? Как изменятся их результаты?
При дефиците В12 из-за разрушения в красном костном мозге мегалобластов будет повышен уровень билирубина. При дефиците В6, т.к. он является коферментом синтеза гема, будет снижено количество гемоглобина.
Билет 20.
Посттранскрипционный процессинг. Основные этапы. Значение. Регуляция биосинтеза белка на уровне транскрипции.
Первичные транскрипты мРНК, прежде чем будут использованы в ходе синтеза белка, подвергаются ряду вокалентной модификации. Эти модификации необходимы для функционирования мРНК в качестве матрицы.
Модификация 5’ – конца.
Начинается на стадии элонгации.
Когда длина первичного транскрипта достигает примерно 30 нуклеотидных остатков, происходит кэпирование его 5’ – конца гуанилилтрансферазой, которая гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5’ – фосфатной группой к 5’ – концу синтезированного фрагмента РНК с образованием 5’, 5’ – фосфодиэфирной связи.
Последующее метилирование остатка гуанина в составе ГТФ с образование N7-метилгуанозина завершает формирование кэпа.
Модифицированные 5’ – конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5’ – экзонуклеаз в цитоплазме.
Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также нужно для работы сложной ферментной системы, обеспечивающей удаление интронов.
3’ – конец транскриптов, синтезированных РНК – полимеразой II, также подвергаются модификациям, при которых специальным ферментом полиА – полимеразой формируется полиА – последовательность (полиА – «хвост»), состоящая из 100-200 остатков адениловой кислоты.
Сигнал к началу полиаденилирования – последовательность –AAUAAA- на растущей цепи РНК
К 3’ – концу в точке разрыва полиА – полимераза наращивает полиА – «хвост». Наличие полиА – последовательности на 3’ – конце облегчает выход мРНК из ядра и замедляет её годролиз в цитоплазме.
Последовательности нуклеотидов, присутствующие в ДНК, но не входящие в состав зрелой мРНК – интроны, а последовательности, присутствующие в мРНК, - кодирующие, или экзоны.
Первичный транскрипт – строго комплементарная матрице нуклеиновая кислота (пре – мРНК), содержащая как экзоны, так и интроны. Длина – от 80 до 1000 нуклеотидов.
Последовательности интронов «вырезаются» из первичного транскрипта, концы экзонов соединяются друг с другом. Такая модификация РНК – сплайсинг. Происходит в ядре, в цитоплазму поступает уже «зрелая» мРРНРНК.
Процесс «вырезания» интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП), в состав которых входит малая ядерная РНК, нуклеотидная цепь которой связана с белковым остовом, состоящим из нескольких протомеров.
первичный транскрипт тРНК содержит около 100 нуклеотидов, а после процессинга – 70-90 нуклеотидных остатков.
Происходят при участии РНК-аз (рибонуклеаз).
Формирование 3’ – конца тРНК катализирует РНК-аза, представляющая собой 3’ – экзонуклеазу, «отрезающую» по одному нуклеотиду, пока не достигает последовательности
-ССА, одинаковой для всех тРНК.
Пре – тРНК содержит всего один интрон, состоящий из 14-16 нуклеотидов. Удаление интрона и сплайсинг приводят к формированию структуры, называемой «антикодон» - триплета нуклеотидов, обеспечивающего взаимодействие тРНК с комплементарным кодоном мРНК в ходе синтеза белков.
Гены рРНК транскрибируются РНК – полимеразой I с образованием идентичных транскриптов. Первичные транскрипты имеют длину около 13000 нуклеотидных остатков (45S рРНК).
Прежде чем покинуть ядро в составе рибосомной частицы, молекула 45S рРНК подвергается процессингу, в результате образуется 28S рРНК (около 2000 нуклеотидов) и 5,8S рРНК (около 160 нуклеотидов), которые являются компонентами рибосом. Остальная часть транскрипта разрушается в ядре.
Рибосома – органелла клетки, участвующая в биосинтезе белка. Рибосома эукариотов состоят из двух, большой и малой, субъединиц: 60S и 40S. Белки рибосом выполняют структурную, регуляторную и каталитическую функции.
Транскрипция – первая стадия реализации генетической информации в клетке. В ходе процессинга образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции.
Происходит в ядре. ДНК служит только матрицей и в ходе транскрипции не изменяется.
Рибонуклеозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) – субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования 3’, 5’ – фосфодиэфирной связи между рибонуклеозидмонофосфатами.
Синтез РНК начинается в определённых последовательностях (сайтах) ДНК – промоторах, и завершается в терминирующих участках (сайты терминации).
Участок ДНК, ограниченный прогмотором и сайтом терминации – единица транскрипции – транскрипт.
Транскрипционные факторы – белки, взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транскриптонах = 1:9(эукариоты).
Биосинтез РНК осуществляется ДНК – зависимыми РНК – полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК – полимеразы: РНК – полимераза I, синтезирующая пре – рРНК, РНк – полимераза II, синтезирующая пре – мРНК, РНК – полимераза III – синтезирующая пре – тРНК.
РНК – полимеразы – олигомерные ферменты, состоящие из нескольких субъединиц - 2α, β, β’, σ. Субъединица σ выполняет регуляторну. Функцию, это один из факторов инициации транскрипции.
РНК – полимеразы I, II, III, узнающие разные промоторв, содержат разные по стороению субъединицы σ.
Инициации. Характеризуется активацией промотора с помощью белка – ТАТА – фактора. Его присоединение облегчает взаимодействие промотора с РНК – полимеразой. Образуется транскрипционная вилка.
Элонгация. Её факторы повышают активность РНК – полимеразы и облегчают расхождение цепей ДНК. Синтез РНК идёт от 5’- к 3’ – концу комплементарно матричной цепи ДНК.
Терминация. Раскручивание двойной спирали ДНК в области терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определённых участках матрицы – терминаторах (сайты терминации). Фактор терминации облегчает отделение первичного транскрипта (пре – мРНК), комплементарного матрице, и РНК – полимеразы от матрицы. РНК – полимераза может вступить в следующийц цикл транскрипции после присоединения субъединицы σ.
Образование кетоновых тел. Биологическая роль процесса. Причины и последствия кетоза.
В печени часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы. К кетоновым телам относят β – гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел.
При низком соотношении инсулин – глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большом количестве, чем в норме. Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для ГНГ. В результате скорость образования ацетил – КоА превышает способность ЦТК окислять его. Ацетил – КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез начинается с взаимодействия двух молекул ацетил – КоА, которые под действием фермента тиолазы образуют ацетоацетил – КоА. С ним взаимодействует третья молекула ацетил – КоА, образуя 3-гидрокси – 3 – метилглутарил – КоА (ГМГ – КоА). Эту реакцию катализирует расщепление ГМГ – КоА на свободный ацетоацетат и ацетил – КоА.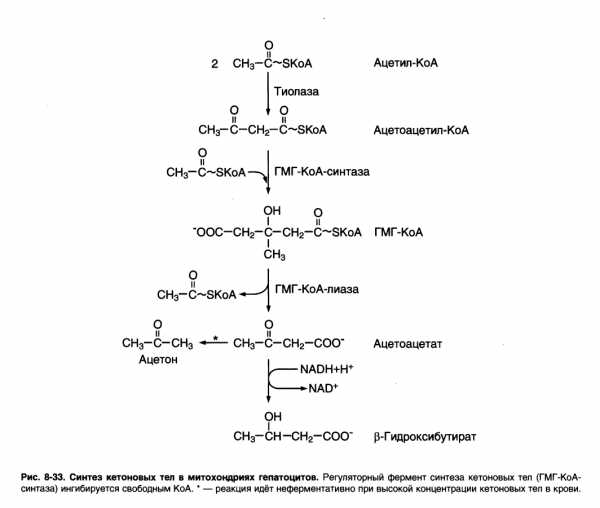
Ацетоацетат может выделяться в кровь или превращаться в печени в β – гидроксибутират восстановлением.
При активном β – окислении создается высокая концентрация НАДН, что способствует превращению большей части ацетоацетата в β – гидроксибутират. Именно он свляется основным кетоновым телом. При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью.
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и мочой. Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.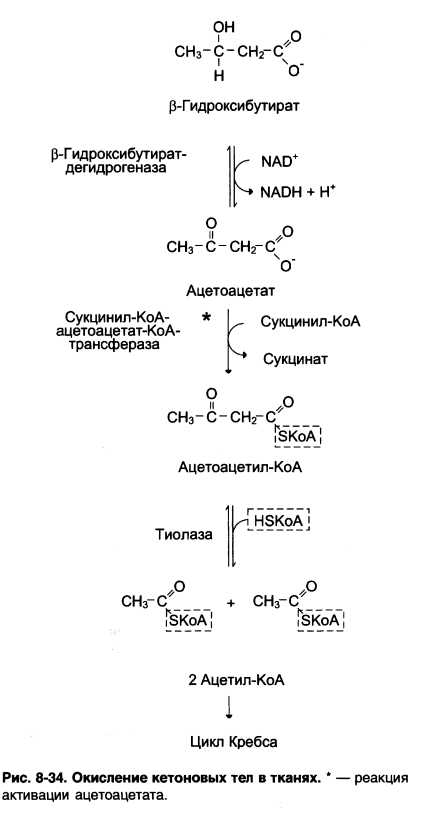
Регуляция синтеза: ГМГ – КоА – синтаза. 1) индуцируемый фермент, его синтез увеличивается при повышении концентрации жирных кислот в крови. Это происходит при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или нагрузке. 2) ингибируется высокими концентрациями свободного кофермента А. 3) когда поступление жирных кислот в клетки увеличивается, КоА связывается с ними, концентрация свободного КоА снижается, и фермент становится активным. 4) если поступление жирных кислот в клетки печени уменьшается, то увеличивается концентрация свободного КоА, ингибирующего фермент. Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Синтез кетоновых тел в периферических тканях. Рисунок 8-34.
Кетоацидоз. В норме концентрация кетоновых тел в крови = 1-3мг/мл. Увеличение кетоновых тел в крови - кетонемия, выделение с мочой – кетонурия. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсаторному ацидозу), а в тяжёлых случаях – к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) – водорастворимые органические кислоты, способные к диссоциации: СН3-СО-СН2-СООН <-> СН3-СО-СН2-СОО+Н.
Назначьте биохимическое обследование больному с подозрением на поражение поджелудочной железы.
Проверить активность пищеварительных ферментов поджелудочной железы – амилазы, панкреатической липазы, химотрипсина и трипсина.
studfiles.net
Эутирокс для похудения стал использоваться несколько лет назад. Прежде чем выяснить его эффективность при похудении, стоит сказать о том, что Эутирокс относят к числу препаратов гормона щитовидной железы. В небольшой дозе препарат оказывает анаболическое действие на белковый и жировой обмен. Средняя доза препарата ведет к улучшению функционирования ЦНС, а также сердечно-сосудистой системы.
Назначают данный препарат при эутиреоидном зобе, гипотиреозе, диффузном токсичном зобе и т.д. При этом нигде не сказано о необходимости назначения Эутирокса для похудения.
Применение этого препарата имеет ряд нюансов. В первую очередь стоит сказать о том, что не следует назначать себе самостоятельно Эутирокс для похудения. Дело в том, что этот медикамент – гормональный. Его применение должно быть строго согласовано с врачом. Не исключено, что применение Эутирокса без назначения врача и контроля с его стороны способно дать обратный эффект, т.е. пациенты набирали вес еще больше.
Это может произойти после длительного гипотиреоза. Препарат в данной ситуации ведет к ускорению метаболизма, быстрому усвоению пищи. Все это может привести к повышению аппетита. В данном случае обязательно осуществлять контроль над процессом приема пищи, не позволяя ничего лишнего. В противном случае можно столкнуться с еще большим набором веса.
Желающие потерять лишние килограммы должны понять, что эутирокс не предназначается специально для похудения. Он оказывает лишь действие на эндокринную систему организма. В то же время препарат ведет к ускорению обмена веществ и это, в свою очередь, помогает снизить вес.
Принимая Эутирокс, важно не увеличивать ту дозу, которая была рекомендована. Это может негативным образом отразиться на здоровье. Можно нанести вред сердцу, костям, щитовидной железе и нервной системе.
Не стоит принимать Эутирокс исключительно ради того, чтобы избавиться от лишнего веса. Этот препарат может привести к побочному действию при неправильной дозировке. При возникновении нежелательных симптомов от употребления данного препарата следует отказаться от дальнейшего его употребления.
www.kak-poxudet.ru
 Красивое тело хотят иметь не только представительницы женского пола - многие мужчины тоже трепетно относятся к своей внешности и усиленно занимаются в тренажерных залах. Чтобы не только получить подтянутую фигуру, но и увеличить мышечную массу, обрести рельефные формы, некоторые мужчины принимают специальные добавки, другими словами – анаболики. Анаболик – это фактически любой препарат, который способствует приросту мышечной массы.
Красивое тело хотят иметь не только представительницы женского пола - многие мужчины тоже трепетно относятся к своей внешности и усиленно занимаются в тренажерных залах. Чтобы не только получить подтянутую фигуру, но и увеличить мышечную массу, обрести рельефные формы, некоторые мужчины принимают специальные добавки, другими словами – анаболики. Анаболик – это фактически любой препарат, который способствует приросту мышечной массы.
В обычной жизни организм человека непрерывно разрушает и устраняет старые клетки и ткани, заменяя их новыми. Этот процесс медики называют катаболизмом. Противоположный катаболизму процесс называется анаболизмом, он характеризуется выработкой молодых, новых клеток. Специальные пищевые добавки оказывают аналогичное действие и способствуют быстрому увеличению мышечной массы. Это - анаболики для быстрого роста мышц. Они изготавливаются на основе гормона тестостерона, выработка которого свойственна в большей степени мужчинам. Выпускаются эти препараты в виде таблеток или капсул, и принимаются внутрь по специальной схеме. Существуют также анаболики для мышц, которые необходимо принимать длительное время. Выпускаются они в виде инъекций.
Анаболик – это препарат, усиливающий обмен веществ, а также помогающий быстрее усваиваться тем веществам, которые отвечают за обновление тканей организма. В первую очередь он улучшает белковый и минеральный обмен. Учитывая то, что в основе анаболиков лежит тестостерон, данный вид добавок способствует образованию мускулистой мужской фигуры. Анаболики для роста мышц иногда назначаются специалистами в медицинских целях, например, при сильном истощении пациента, после серьезных травм и тяжелых заболеваний. Эти вещества врачи выписывают тогда, когда организм человека сам не может справиться с выработкой новых клеток. Но наиболее часто анаболики для мышц приобретают абсолютно здоровые люди – спортсмены и культуристы. И принимают они эти вещества не в медицинских целях, а для получения рельефной мускулатуры и увеличения физической силы.
 Анаболик – это, по сути, допинг, и в большом спорте он запрещен. Но все равно культуристы, бодибилдеры, спринтеры и прочие спортсмены активно используют упомянутое вещество для повышения своих результатов. При этом дозировка анаболиков, принимаемых спортсменами, значительно отличается от тех доз, которые выписывают врачи в лечебных целях. Когда данные добавки только начали появляться (в 60-х годах прошлого века), наличие их в крови человека еще не умели определять, поэтому запрета на анаболики в то время не существовало. Сейчас они входят в перечень запрещенных в спорте препаратов, и тест на использование анаболических стероидов проводится не только на состязаниях, но и во время тренировок.
Анаболик – это, по сути, допинг, и в большом спорте он запрещен. Но все равно культуристы, бодибилдеры, спринтеры и прочие спортсмены активно используют упомянутое вещество для повышения своих результатов. При этом дозировка анаболиков, принимаемых спортсменами, значительно отличается от тех доз, которые выписывают врачи в лечебных целях. Когда данные добавки только начали появляться (в 60-х годах прошлого века), наличие их в крови человека еще не умели определять, поэтому запрета на анаболики в то время не существовало. Сейчас они входят в перечень запрещенных в спорте препаратов, и тест на использование анаболических стероидов проводится не только на состязаниях, но и во время тренировок.
Регулярный прием анаболических стероидов обеспечивает формирование красивого мускулистого тела и быстрый рост мышечной массы. Но эти вещества совсем не безобидны, ведь не зря они вошли в список запрещенных средств. Как мы уже упоминали, анаболики относятся к допингам, поэтому использование их для улучшения спортивных успехов запрещено. К тому же, они основательно подрывают здоровье человека и приводят к нарушениям в работе внутренних органов и систем. Коварство анаболических стероидов заключается в том, что сбой в работе того или иного органа обнаруживается не сразу, а спустя некоторое время. Поэтому в большинстве случаев болезнь выявляется тогда, когда она уже запущена, и ее лечение требует немалых усилий и денежных средств.
Регулярный прием анаболиков приводит к появлению следующих побочных эффектов:
У представителей мужского пола нередко возникает импотенция, воспаление предстательной железы, снижается активность сперматозоидов, возникают сложности с зачатием ребенка. Прием анаболиков женщинами приводит к нарушениям менструального цикла и повышенному росту волос ( влияние мужского гормона на женский организм). Кроме того, у представительниц прекрасного пола нередко грубеет голос. Подросткам принимать анаболики особенно опасно, потому как, кроме нарушений в работе всех систем и органов, это приводит к прекращению роста. Нередко влияние рассматриваемых веществ на неокрепший молодой организм оказывается настолько сильным, что возникает задержка в его развитии. Очень часто употребление в пищу анаболиков приводит к повышению травматизма. Причина этого явления в том, что от злоупотребления стероидами мышцы стремительно увеличиваются в размерах, а вот связки и кости остаются в прежнем состоянии и не выдерживают такой нагрузки. Чем быстрее растут мышцы, тем больше возрастает риск разрыва сухожилий, но это обратная сторона медали. Как правило, в погоне за мускулистым телом люди об этом не задумываются. Либо просто не знают о всех последствиях приема анаболиков. Коварство этих веществ заключается еще и в том, что работоспособность, прилив сил и рост мышц происходит только при употреблении упомянутых добавок. Если их прием прекратить, то все возвращается на исходную позицию, что вынуждает человека снова и снова принимать препараты и даже увеличивать их дозировку. А отказаться от анаболиков бывает непросто, так как человек просто попадает в зависимость от препарата.
 Но не все анаболики вредны. Существуют растения, обладающие легким анаболическим эффектом. Благодаря своему натуральному происхождению, они не нарушают баланс организма, но способствуют росту мышечной массы. Природные анаболики для роста мышц – это сельдерей, укроп, черемша, пастернак и хрен. Пусть от их употребления мышечная масса увеличивается не так быстро, как от синтетических препаратов, зато они не подрывают здоровье человека, не приводят к побочным эффектам и не запрещены к использованию на спортивных соревнованиях. Поэтому, прежде чем принимать анаболики с целью скорейшего наращивания мышц, тщательно взвесьте все “за” и “против”, а также проконсультируйтесь с врачом о возможных последствиях употребления подобных препаратов. Ведь анаболик – это не безобидные витамины или сывороточный протеин, а вещества, оказывающие сильное воздействие на организм и поэтому требующие строгого контроля и употребления в рекомендованных дозировках, превышать которые строго не рекомендуется.
Но не все анаболики вредны. Существуют растения, обладающие легким анаболическим эффектом. Благодаря своему натуральному происхождению, они не нарушают баланс организма, но способствуют росту мышечной массы. Природные анаболики для роста мышц – это сельдерей, укроп, черемша, пастернак и хрен. Пусть от их употребления мышечная масса увеличивается не так быстро, как от синтетических препаратов, зато они не подрывают здоровье человека, не приводят к побочным эффектам и не запрещены к использованию на спортивных соревнованиях. Поэтому, прежде чем принимать анаболики с целью скорейшего наращивания мышц, тщательно взвесьте все “за” и “против”, а также проконсультируйтесь с врачом о возможных последствиях употребления подобных препаратов. Ведь анаболик – это не безобидные витамины или сывороточный протеин, а вещества, оказывающие сильное воздействие на организм и поэтому требующие строгого контроля и употребления в рекомендованных дозировках, превышать которые строго не рекомендуется.
fb.ru
способствует синтезу жирных кислот из глюкозы путём активирования ацетил-КоА‑карбоксилазы и синтазы жирных кислот. Жирные кислоты, присоединяя -глицерофосфат, превращаются в триглицериды.
подавляет окисление жирных кислот вследствие увеличенного превращения ацетил-КоА в малонил-КоА. Малонил-КоА ингибирует активность карнитин ацилтрансферазы (транспортирует жирные кислоты из цитоплазмы в митохондрии для их ‑окисления и превращения в кетокислоты. Другими словами, инсулин оказывает антикетогенный эффект.
увеличивает окисление пирувата путём активирования пируватдегидрогеназы и ацетил-КоА‑карбоксилазы, что благоприятствует синтезу свободных жирных кислот;
увеличивает транспорт глюкозы в липоциты, последующее превращение которой приводит к появлению -глицерофосфата.
способствует синтезу триглицеридов из -глицерофосфата и свободных жирных кислот;
предупреждает расщепление триглицеридов на глицерол и свободные жирные кислоты, ингибируя активность гормон-чувствительной триглицерид липазы;
активирует синтез липопротеин липазы, транспортируемой к клеткам эндотелия, где этот фермент расщепляет триглицериды хиломикронов и липопротеинов очень низкой плотности.
Эти процессы существенно замедляются при дефиците инсулина.
Сахарный диабет и атеросклероз. В печени избыток жирных кислот на фоне дефицита инсулина способствует превращению жирных кислот в фосфолипиды и холестерол. Эти вещества вместе с триглицеридами поступают в кровь в виде липопротеинов, где их концентрация может увеличиваться в 2–3 раза, достигая нескольких процентов (в норме 0,6%). Такая высокая концентрация холестерола (особенно в составе липопротеинов низкой плотности) приводит у диабетиков к быстрому развитию атеросклероза.
Кетоацидоз при сахарном диабете. При дефиците инсулина и на фоне избыточного содержания жирных кислот в печени образуется ацетоуксусная кислота. В норме значительная часть ацетоуксусной кислоты в разных клетках организма, проходит ряд превращений и используется для энергии. Отсутствие инсулина подавляет использование ацетоуксусной кислоты периферическими тканями. Таким образом, избыток ацетоуксусной кислоты, выделяемой печенью, не используется периферическими тканями. Возникает тяжёлое состояние повышенной кислотности жидкостей тела — ацидоз. Кроме этого, часть ацетоуксусной кислоты превращается в -гидроксимасляную кислоту и ацетон, называемые кетоновыми телами. Накопление в организме больших количеств этих веществ вместе с ацетоуксусной кислотой называется кетозом.
Эффекты инсулина на белковый обмен и рост организма
Инсулин в печени, скелетных мышцах, а также в других органах-мишенях и клетках-мишенях стимулирует синтез белка и подавляет его катаболизм. Другими словами, инсулин – сильный анаболический гормон. Анаболическое влияние инсулина реализуется несколькими путями. Инсулин:
стимулирует поглощение АК клетками;
усиливает транскрипцию генов и трансляцию мРНК;
подавляет распад белков (особенно мышечных) и их освобождение в кровь;
уменьшает скорость глюконеогенеза из АК.
Анаболические эффекты инсулина и гормона роста синергестичны, что не в последнюю очередь определяется тем обстоятельством, что эффекты гормона роста реализуются посредством инсулиноподобного фактора роста – соматомедина С.
ГЛЮКАГОН и ГЛЮКАГОНОПОДОБНЫЕ ПЕПТИДЫ
Ген глюкагона содержит последовательности, кодирующих структуру нескольких физиологически родственных гормонов с эффектами глюкагона. В результате транскрипции образуется мРНК препроглюкагона, но эта мРНК по-разному расщепляется в α-клетках островков Лангерханса и эндокринных L-клетках слизистой оболочки верхних отделов тонкого кишечника, приводя к образованию разных мРНК проглюкагона.
Глицентин состоит из 69 АК остатков, стимулирует секрецию инсулина и желудочного сока, а также принимает участие в регуляции моторики ЖКТ. Глицентин обнаружен также в нервных клетках Гт и ствола мозга.
Глюкагоноподобный пептид 1 – самый мощный стимулятор вызванной глюкозой секреции инсулина (именно поэтому, в частности, тест на толерантность к глюкозе проводят перорально, а не в/в). Этот пептид подавляет желудочную секрецию и расценивается как физиологический медиатор чувства насыщения. Пептид синтезируется также в нейронах паравентрикулярного ядра Гт и нейронах центрального ядра миндалевидного тела. Обе группы нервных клеток принимают непосредственное участие в регуляции пищевого поведения.
Глюкагоноподобный пептид 2 стимулирует пролиферацию клеток кишечных крипт и всасывание в тонком кишечнике.
studfiles.net
Незаменимые жирные- кислоты — линолевая, линоленовая и. арахидоновая, по-видимому, осуществляют в животном организме функции окисления насыщенных жирных кислот, участвуя тем самым в процессе усвоения жиров [13] и в жировом обмене кожных покровов [14]. [c.621]
Последний фрагмент является активной частью кофермента, так как его тиольная группа легко образует тиоэфирные связи с карбоксильными остатками кислот и переносит их на другие субстраты (например, ацетильную группу передает в цикл три-карбоновых кислот - цикл Кребса). КоА участвует в углеводном и жировом обмене и в синтезе важных биомолекул. [c.168]
Биотин (витамин Н) — органическое вещество, входит в состав ферментов, регулирующих белковый и жировой обмен, обладает высокой активностью. При недостатке Б. наблюдаются поражения кожи, мышечная слабость, замедляется рост. Наиболее богаты Б. дрожжи, помидоры, шпинат, соя, яичный желток. Б. в живом организме концентрируется в печени, почках. [c.26]
Кортизон относится к группе кортикостероидов. Он обладает жаропонижающим действием, особенно при лечении ревматоидного артрита. Холевая кислота входит в группу холевых (желчных) кислот, обладает свойствами поверхностно-активного вещества (ПАВ см. разд. 21.6) и регулирует жировой обмен в организме. [c.236]
Он встречается в некоторых растениях и мыщечной ткани животных. Витамин Вт является активным метаболитом, стимулирует биосинтез белка, проявляет анаболическое действие, нормализуя белковый и жировой обмен, улучшая аппетит, ускоряя рост и увеличивая массу тела. Показан в педиатрии, а также взрослым при хронической ишемической болезни сердца, нервном и физическом истощении, после операций и в спортивной медицине. [c.46]
Витамин Ва связан, кроме того, с углеводным и жировым обменом, метаболизмом аминокислот он необходим для нормального зрения. Эйлер (1938) объясняет влияние витамина В. его светочувствительностью, благодаря которой он превращает действующие на него фиолетовые и синие лучи в длинноволновые (светло-зеленой флуоресценции), к. которым глаз обладает большей чувствительностью таким образом, витамин Bj выполняет как бы роль сенсибилизатора. [c.675]
П. к. в виде КоА участвует в углеводном и жировом обмене, в синтезе ацетилхолина, в коре надпочечников стимулирует образование кортикостероидов. [c.443]
Жировой обмен в организме может быть нарушен в результате нарушения углеводного обмена. Например, при тяжелых формах диабета (сахарная болезнь) происходит нарушение процессов окисления жиров в крови накапливаются промежуточные продукты окисления жиров — ацетоновые тела (ацетон, ацетоуксусная и р-окси-масляная кислоты), вследствие чего ацетоновые тела появляются и в моче. Это явление называется ацетонурией. [c.165]
Участвует в жировом обмене в частности в ути лизации непредельных жирных кислот [c.10]
Предполагается участие в жировом обмене организма [c.10]
В конце 60-х годов в состав косметических изделий начали все более широко вводить полезные добавки и в первую очередь витамины, а также соки и настои некоторых овощей, целебных трав и растений. За счет использования биологически активных добавок удалось создавать эффективные средства целенаправленного действия, влияющие на биологические функции кожи, оказывающие тонизирующее действие, усиливающие белковый, жировой обмен, улучшающие состояние кожи, волос. [c.8]
Отечественная промышленность выпускает для ухода за сухой и нормальной кожей лица кремы, содержащие различные добавки витамины, растительные экстракты, аминокислоты, а также вещества, усиливающие жировой обмен. [c.14]
КРЕМ ЛЕСНАЯ НИМФА изготовлен на основе водно-спиртового настоя биомассы женьшеня, который является активным препаратом, стимулирующим физиологическую активность клеток эпидермиса, белковый и жировой обмен. Крем оказывает эффективное тонизирующее действие на кожу. Жировые компоненты крема — оливковое масло, ланолин, пчелиный воск и другие — хорошо смягчают кожу. Особенно полезен при вялой, анемичной коже, а также тем, кому за тридцать. [c.21]
К высокоэффективным косметическим средствам для ухода за сухой и увядающей кожей лица можно отнести также кремы со специально подобранными добавками, усиливающими жировой обмен в коже. [c.23]
КРЕМ БЕРЕЗКА особенно рекомендуется для ухода за сверхчувствительной и легкораздражимой кожей лица и шеи. Изготавливается из высококачественного сырья. Жировые компоненты крема — спермацет, ацетилированный ланолин, косточковое и кукурузное масло, а также пчелиный воск — оказывают благотворное действие на кожу. Крем хорошо смягчает кожу, устраняет сухость, предупреждает преждевременное появление морщин. Имеет приятную консистенцию, легко впитывается. Кремом можно пользоваться в любое время дня. Небольшое количество крема легкими движениями кончиков пальцев наносят на чистую кожу лица и шеи. КРЕМ ЗОДИАК . Эффективный крем для сухой и нормальной кожи. В его состав входят натуральное сырье оливковое масло, спермацет, ланолин, а также норковое масло, которое усиливает жировой обмен в клетках кожи. Крем хорошо смягчает кожу, придает ей бархатистость и шелковистость, имеет нежную консистенцию, легко впитывается кожей. [c.24]
КРЕМ АЗАЛИЯ — жидкий крем, предназначенный для очистки кожи лица, чувствительной к умыванию водой. Крем содержит высококачественные натуральные жировые компоненты. В качестве биологически активного вещества в крем введен экстракт азалии, регулирующий жировой обмен кожи. Крем хорошо очищает кожу от загрязнений и декоративной косметики. Оказывает смягчающее дейст- [c.35]
Основу крема составляет высокопитательный жир норки, который способствует проникновению биологически активных натуральных жировых компонентов в более глубокие слои кожи и тем самым улучшает жировой обмен. Крем тонизирует кожу вокруг глаз, обладает выраженным смягчающим действием. [c.37]
Холин физиологически активен и играет в жизнедеятельности человека и животных важную роль. Он понижает кровяное давление является витамином, регулирующим жировой обмен. Холин отдает свои метильные группы в процессах метилирования в организме. [c.370]
ЯИЧНОЕ МАСЛО- натуральный продукт, получаемый из сырого яичного желтка путем экстракции этиловым спиртом с последующей отгонкой спиртовой фракции, Густая однородная, сиропообразная жидкость от светло-желтого до темножелтого цвета с запахом, свойственным яичному желтку, без постороннего приза-паха. Плотность 0,97 г/см , йодное число не менее 25, Растворяется в этиловом спирте, В состав яичного масла входят ценные вещества, регулирующие жировой обмен в коже фосфолипиды (лецитин, кефалин и др,), ненасыщенные жирные кислоты, [c.170]
Атрофия железы у взрослых вызывает заболевание, которое называется микседемой, или слизистым отеком (рис. 11). Накопление воды и ожирение при микседеме говорят о том, что гормоны щитовидной железы влияют на водный и жировой обмен. [c.141]
Углеводное питание занимает важное место в жизни человека. Превращаясь в молочную кислоту, углеводы дают клетке необходимую энергию (1 г углеводов дает 16,74 кДж). Углеводы выполняют детоксирующую (барьерную) функцию, заключающуюся в образовании глюку-роновой кислоты, которая, соединяясь с ксенобиотиками и их метаболитами, дает нетоксичные и легко выводимые из организма вещества. Углеводы снижают накопление в организме кетоновых тел, входят в состав нуклеиновых кислот, регулируют жировой обмен, уменьшают количество потребляемого белка. [c.3]
Из желез внутренней секреции, через которые нервная система оказывает влияние на жировой обмен, можно упомянуть гипофиз. Действие секрета передней доли гипофиза на жировой обмен не подлежит сомнению. Гипофункция железы резко отражается на обмене жиров, вызывая отложение больших количеств жира в организме (заболевание, известное под названием гипофизарного ожирения). [c.296]
При поступлении в организм сахара извне или при накоплении в печеночных клетках известного количества гликогена в результате, например, введения в организм больного диабетом инсулина жировой обмен возвращается к норме. [c.300]
С белковым голоданием связан также распад ряда ферментных белков, которые выполняют каталитическую функцию в углеводном или жировом обмене. Действительно, было обнаружено, что печень крыс, находившихся 15—20 дней на малобелковой диете, была практически лишена гликогена, несмотря на большое количество углеводов в пище и высокую ее калорийность. [c.371]
Витамины группы Ве необходимы для нормального кровеобразования. Так, у собак и свиней при Вв-авитаминозе развивается анемия, сопровождающаяся ненормально повышенным содержанием железа в сыворотке крови 193]. У людей этого явления обнаружено не было. При авитаминозе у цыплят наблюдается ускорение свертывания крови. Витамины группы Ве принимают участие в жировом обмене и способствуют утилизации ненасыщенных жирны.х кислот [194]. Витамин В применяется в послелучевой терапии. [c.355]
Витамины группы В. Витамин Bi (тиамин) —гетероциклическое соединение состава i2H]gON4S 2 — участвует в жировом обмене и тонизирует нервную систему. В организме он соединяется с двумя молекулами фосфорной кислоты и образует активную группу фермента карбоксилазы, способствующего разложению промежуточного продукта расщепления углеводов — пировиноградной кислоты. Витамин Bi устойчив при нагревании в кислой среде, но быстро инактивируется в щелочной. Содержится в дрожжах, семенах злаковых и бобовых культур (в наружной оболочке и зародышах семян), в печени жи- [c.133]
Витамин Вб (пиридоксин) eHnOsN.- производное пиридина. В организме фосфорилируется и входит в состав ферментов, участвующих в жировом обмене и осуществляющих пере-аминирование аминокислот. Рекомендуется как средство, способствующее росту волос и препятствующее облысению. Отлично смягчает кожу (как свежий яичный желток). [c.134]
Холин (триметил-2-гидроксиэтиламмоний) — структурный мент сложных липидов (см. 14.1.3). Имеет большое значение витаминоподобное вещество, регулирующее жировой обмен, организме холин может образоваться из аминокислоты сери-При этом сначала в результате декарбоксилирования серина учается 2-аминоэтанол (коламин), который затем подвергает-йсчерпывающему метилированию при участии S-аденозилме-)кина (SAM) (см. 6.8 и 13.3). [c.253]
Кетоновые тела (Р-гидрооксимасляная кислота, аце-тоуксусная и ацетон) появляются в моче при нарушениях углеводного и жирового обменов, в частности при диабете, а также при голодании. В нормальной моче кетоновые тела обычными реакциями не обнаруживаются. Определение кетоновых тел в моче очень важно для диагностики заболевания, для контроля за ходом лечения и установлением диеты для больного диабетом. [c.218]
Крем благоприятно действует на обменные процессы в коже (белковый и жировой обмен), проявляет гидратантные свойства. Биокрем предупреждает преждевременное появление морщин, смягчает кожу и делает ее более эластичной, придает свежий вид. Можно применять в дневное и вечернее время. Его наносят на чистую кожу лица на 40—50 минут, после избыток крема удаляют бумажной салфеткой. КРЕМ ЯИЧНЫЙ Этот биокрем благодаря содержанию в нем биологически активного яичного масла, получаемого из свежих куриных яиц, является хорошим стимулирующим средством для поднятия тонуса клеток кожи, улучшает жировой обмен в сухой коже. [c.23]
ЛОСЬОН ФЛОРА эффективно очищает и тонизирует кожу, а также уменьшает потоотделение. Приготовлен на настоях лекарственных растений — подорожника, зверобоя и тысячелистника, хорошо известных своими целебными свойствами. При жирной коже полезно протирать лицо после умывания. Для более глубокой очистки и тонизирования кожи полезны маски, которые рекомендуется делать из лосьона 1—2 раза в неделю. Лицо предварительно очищают от пыли, грязи и естественных выделений кожи. Лосьоном, разбавленным кипяченой водой в соотношении 1 1, смачивают марлевую салфетку, сложенную в несколько слоев и имеющую отверстие для глаз и носа. Салфетку накладывают на лицо на 15—20 минут. Лосьон хранят в темном прохладном месте. ЛОСЬОН СОЛО — тонизирующий лосьон, предназначенный для ухода за нормальной и жирной кожей лица. Настой биомассы женьшеня, входящий в его состав, стимулирует физиологическую активность тканей, белковый и жировой обмен способствует повышению жизнедеятельности кожи и поддержанию ее тонуса, противодействует увяданию кожи. Лосьон имеет приятный аромат, хорошо очищает кожу лица, дезинфицирует, смягчает ее, придает чувство свежести. [c.29]
Человек. При вдыхании 4300 и 8600 мг/м дважды в день в течение 5 дней у мужчин-добровольцев отмечено незначительно угнетение функции ЦНС, не влиявшее на работоспособность по тестам внимания. При обследовании 50 человек, работавших в контакте с Т. (концентрации в течение 6-ч рабочего дня колебались в пределах 400—40000 мг/м и равнялись в среднем 5800 мг/м ) в течение 3,5—4,5 лет, не было выявлено существенных сдвигов в состоянии здоровья и показателях белкового, углеводного и жирового обменов, а также функции печени однако у работающих отмечались более частые риниты, бронхит и астма по сравнению с контрольной группой. Рабочие с 10-летним стажем при концентрации в воздухе 178—477 мг/м предъявляют жалобы на головные боли, головокружения, особенно Б конце рабочего дня. В начале смены в выдыхаемом воздухе и в сыворотке крови Т. отсутствует, в конце смены в выдыхаемом воздухе до 25 мг/м , в сыворотке крови у женщин 9,75 мг/м , у мужчин 1,2—4,85 мг/м . Содержание лейкоцитов, эритроцитов, НЬ и трансаминаз в крови, белка и сахара в моче — в пределах нормы (Trieberg, Burkhardt). У монтеров телефонных сетей, применяющих Т. для очистки контактов (концентрации в воздухе 4 600—29 500 мг/м ), жалобы на головные боли, головокружения, тошноту, боли в области живота. На биопсии выявлена жировая дистрофия печени (Lun, S hmidt). [c.637]
КРЕМ ОДИССЕЙ . Тонизирующий крем для мужчин. Содержит апилак лиофилизи-рованный, который является биологическим стимулятором, В состав крема входят яичное масло, усиливающее жировой обмен кожи. Крем имеет мягкую, нежную консистенцию, легко наносится на кожу, не оставляет жирного блеска, быстро впитывается и имеет приятный ненавязчивый аромат. Хорошо смягчает кожу. [c.49]
Куриное масло оказывает эффективное действие на жировой обмен кожи, масло легко наносится на кожу, быстро впитывается, не оставляя жирной пленки на поверхности, делает кожу мягкой, гладкой Масло легко эмульгируется, вязкость об разуемых эмульсий зависит от темпе ратуры застывания масла. Наименее вяз кие эмульсии образует жидкая фракция а наиболее вязкие — твердая. [c.128]
Недостаток витамина Р приводит к истончению и выпадению волос, появлению перхоти, сухости и щелущению кожи, не-нбрмальному ее ороговению. Витамин Р способствует усвоению жиров, участвует в жировом обмене кожи. [c.159]
В нашей стране разработан способ получения настоя биомассы женьщеня с помощью биотехнологии получаемый продукт близок по своим свойствам природному женьшеню. Настой стимулирует физиологическую активность тканей, белковый и жировой обмен, способствует усилению жизнедеятельности клеток кожи, предотвращает ее преждевременное увядание. [c.160]
chem21.info
Это железа смешанной секреции. Поджелудочная железа, как железа внутренней секреции, продуцирует два основных гормона - инсулин и глюкагон.
Инсулин продуцирует бета-клетками, а глюкагон - альфа-клетками островков Лангерганса.
Эффекты инсулина Инсулин оказывает влияние на все виды обмена веществ, он способствует анаболическим /синтез/процессам, усиливает синтез гликогена, жиров, белков, тормозит эффекты гормонов обладающих катоболическим действием/катехоламины, глюкокортикоиды, глюкогон и др/
Эффекты инсулина по скорости реализации делят на четыре группы
1 очень быстрые /через несколько секунд/- 1.1.повышение проницаемости клеточных мембран для глюкозы, 1.2.активация калий -натриевого насоса/избыток К закачивается в клетку и удаляются из клетки дополнительные порции Na / и как следствие частичная гиперполяризация мембран клеток за исключением гепатоцитов/.
2.быстрые эффекты/в течение нескольких минут/-2.1.активация ферментов, усиливающих анаболические процессы, 2.2.торможение ферментов, ответственных за катоболические процессы
3.медленные эффекты /в течение нескольких часов/- 3.1.повышение проницаемости мембран для аминокислот, 3.2.усиление синтеза иРНК и ферментов синтеза белков
4.очень медленные эффекты/от часов до суток/ активация митогенеза и размножения клеток
Действие инсулина на углеводный обмен
1 увеличение проницаемости клеточных мембран для глюкозы, 2 увеличение транспорта глюкозы из крови в клетки, 3 гипогликемия/как следствие 1 и 2/,
4 активация процессов гликолиза, 5 усиление процессов фосфолирирования,
6 стимуляция синтеза гликогена, 7 торможение распада гликогена, 8 угнетение глюконеогенеза
1 повышение проницаемости мембран для аминокислот, 2 усиление синтеза иРНК, 3 активация в печени синтеза аминокислот, 4 повышение активности ферментов синтеза белков, 5 торможение активности ферментов расщепляющих белки
1 стимуляция синтеза свободных жирных кислот из глюкозы, 2 стимуляция синтеза триглицеридов , 3 активация окисления кетоновых тел в печени, 4 подавление распада жира
Главным регулятором является глюкоза, активирующая в бета –клетках аденилатциклазы, что в конечном итоги приводит к выбросу инсулина из гранул бета- клеток в кровь. Вегетативная нервная система – парасимпатическая и ацетилхолин- стимулируют выброс инсулина в кровь, симпатическая и норадреналин- тормозят этот процесс.
При недостатке инсулина в организме развивается сахарный диабет.
1. Усиливает гликогенолиз в печени и мышцах,2. Способствует глюконеогенезу.
3. Гипергликемия,4. Активирует липолиз/ лизис/, 5. Подавляет синтез жира. 6. Увеличивает систез кетоновых тел в печени, 7.Угнетает их окисление, 8.Стимулирует катоболизм/распад/ белков в тканях, прежде всего в печени, 9.Увеличивает синтез мочевины
Увеличение глюкозы в крови тормозит выделение гормона, уменьшение- стимулирует выброс его в кровь, Симпатическая нервная система и катехоламины стимулируют выброс глюкогона в кровь, а парасимпатическая-тормозит.
20. Женские половые гормоны + 21. Мужские половые гормоны…
Половые гормоны вырабатываются в гонадах - половых железах:
у мужчин - в семенниках, у женщин - в яичниках. Гонады являются железами смешанной секреции. Половые гормоны необходимы для полового созревания и развития вторичных половых признаков. половые гормоны различаются по химическому строению:
1. Стероидные гормоны: а) Андрогены - тестостерон, андростерон, б) Эстрогены - эстрон, эстриол, эстрадиол, в) Прогестерон
2. Пептидные гормоны: а) мужские – ингибин, б) женские - релаксин
В норме в организме обеих полов образуются и мужские и женские половые гормоны.
Эффекты стероидных половых гормонов:
Андрогены в мужском организме вырабатываются в семенниках /в клетках Сертоли/, представлены тестостероном, который вызывает следующие эффекты:
активирует синтез РНК,
обеспечивает процессы половой дифференцировки в эмбриональном периоде, обеспечивает развитие первичных и вторичных мужских половых признаков,
формирование структур ЦНС, обеспечивающих половое поведение,
формирование структур ЦНС, обеспечивающих половые функции,
генерализованное анаболическое действие, обеспечивающее рост скелета, мускулатуры тела,
распределение подкожного жира,
торможение катаболического действия глюкокортикоидов,
регуляция сперматогенезе, участвуют в формировании полового поведения
Эстрогены в женском организме в значительных количествах вырабатываются клетками гранулеза фоликулов/ у мужчин в незначительном количестве-клетками Сертоли/, представлены в основном эстрадиолом, в меньшем количестве синтезируется эстрон.
Они вызывают следующие физиологические эффекты:
активирует синтез РНК, обеспечивают процессы половой дифференцировки в эмбриональном периоде,
половое созревание,
развитие первичных и вторичных женских половых признаков,
установление женского полового цикла,
обеспечивает рост мышцы и железистого эпителия матки, развитие молочных желез,
обладают более слабым анаболическим действием, чем андрогены,
подавляют резорбцию костной ткани,
тормозят анаболический эффект андрогенов.
Эстрогены участвуют
1) в формировании полового поведения,
2) в овогенезе,
3) в процессе оплодотворения и имплантации оплодотворенной яйцеклетки в слизистую матки,
4) в развитии и дифференцировке плода/материнские эстрогены/,
5) в развитии родового акта
Прогестерон- вырабатывается клетками желтого тела/немного клетками гранулезы/- является гормоном сохранения беременности/гестагеном/: ослабляет готовность мускулатуры матки к сокращению, стимулирует овуляцию, тормозит пролиферацию эндометрия, необходим для создания баланса между возбуждением и торможением в ЦНС, препятствует развитию депрессии, раздражительности и плаксивости, которые могут развиться при недостаточности ПГ
Пептидные половые гормоны. Релаксин - продуцируется клетками желтого тела, в матке. Его эффект заключается в расслаблении связок малого таза. Его продукция усиливается в период родов. Ингибин - угнетает сперматогенез при длительном воздержании.
Эндокринная функция плаценты. В плаценте из эстрона образуется эстриол, кроме того плацента синтезирует прогестерон, которые выполняют присущие им функции/см. половые гормоны/ а так же хорионический гонадотропин, который участвует
1.В регуляции дифференцировки и развития плода,
также влияет на организм матери, вызывая:
Задержку воды и солей.
Усиление секреции вазопрессина /задняя доля гипофиза/.
Активацию механизмов иммунитета.
studfiles.net