Коллаген — полиморфный белок, в настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. 95% всего коллагена в организме человека составляют коллагены I, II и III типов.
| Типы | Гены | Ткани и органы |
| I | COLIA1, COL1A2 | Кожа, сухожилия, кости, роговица, плацента, артерии, печень, дентин |
| II | COL2A1 | Хрящи, межпозвоночные диски, стекловидное тело, роговица |
| III | C0L3A1 | Артерии, матка, кожа плода, строма паренхиматозных органов |
| IV | COL4A1-COL4A6 | Базальные мембраны |
| V | COL5A1-COL5A3 | Минорный компонент тканей, содержащих коллаген I и II типов (кожа, роговица, кости, хрящи, межпозвоночные диски, плацента) |
| VI | COL6A1-COL6A3 | Хрящи, кровеносные сосуды, связки, кожа, матка, лёгкие, почки |
| VII | COL7A1 | Амнион, кожа, пищевод, роговица, хорион |
| VIII | COL8A1-COL8A2 | Роговица, кровеносные сосуды, культуральная среда эндотелия |
| IX | COL9A1-COL9A3 | Ткани, содержащие коллаген II типа (хрящи, межпозвоночные диски, стекловидное тело) |
| X | COL10A1 | Хрящи (гипертрофированные) |
| XI | COLUA1-COL11A2 | Ткани, содержащие коллаген II типа (хрящи, межпозвоночные диски, стекловидное тело) |
| XII | COL12A1 | Ткани, содержащие коллаген I типа (кожа, кости, сухожилия и др.) |
| XIII | C0L13A1 | Многие ткани |
| XIV | COL14A1 | Ткани, содержащие коллаген I типа (кожа, кости, сухожилия и др.) |
| XV | C0L15A1 | Многие ткани |
| XVI | COL16A1 | Многие ткани |
| XVII | COL17A1 | Гемидесмосомы кожи |
| XVIII | COL18A1 | Многие ткани, например печень, почки |
| XIX | COL19A1 | Клетки рабдомиосаркомы |
Гены коллагена называются по типам коллагена и записываются арабскими цифрами, например СОL1 — ген коллагена 1 типа, COL2 — ген коллагена II типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид α-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1, и α2-цепи коллагена I типа.
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе:
1. На полисомах ЭПР синтезируются полипептидные препро-α-цепиколлагена. Они содержит начиная сN-конца: 1). гидрофобный «сигнальный» пептид, содержащий около 100 АК; 2). N-концевой пропептид, содержащий около 100 АК, в том числе цистеин; 3). α-цепь коллагена 4). С-концевой пропептид, содержащий около 250 АК, в том числе цистеин. КонцевыеС- и N-пропептидыформируют глобулярные домены и необходимы для правильного формирования тройной спирали.«Сигнальный» пептид, обеспечивает поступление синтезируемой на рибосоме препро-α-цепи в полость ЭПР.
2. В полости ЭПР при отщеплении сигнального пептида препро-α-цепиколлагена превращаются впро-α-цепи.
3. Поступающие в полости ЭПР про-α-цепи коллагенаподвергаются модификации.
а). Цистеины N-пропептидов образуют внутрицепочечные дисульфидные мостики, формируя наN-конце глобулярную структуру;
б). Пролины и лизины в Y-положении (гли-х-у) про-α-цепей гидроксилируются пролил-4-гидроксилазойилизил-5-гидроксилазойв 4-гидроксипролины (Hyp) и 5-гидроксилизины (Hyl). Некоторые пролины в Х-положениях гидроксилируются в 3-гидроксипролины пролил-3-гидроксилазой. Оксигеназы (гидроксилазы), содержат Fe2+, находятся на мембране ЭПР. Для реакции необходимы а-КГ, О2и витамин С:
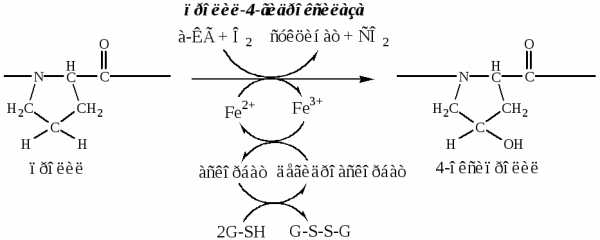
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина участвуют в образовании водородных связей.
Гидроксилирование лизина необходимо для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
в). Гидроксилизин про-α-цепей при участии гликозилтрансфераз гликозилируется галактозой или галактозилглюкозой. В молекуле коллагена сухожилий (тип I) количество углеводов равно 6, а в моллекуле коллагена капсулы хрусталика (тип TV) — 110. Роль этих углеводных групп неясна.
4). В просвете ЭПР после отделения от рибосом про-α-цепей, 3 из них с помощью С-концевых пропептидов соединяются между собой дисульфидными мостиками (цистеины С-пропептидов образуют внутри- и межцепочечные дисульфидные мостики) и скручиваются с образованием тройной спирали проколлагена. Тройная спираль проколлагена стабилизируется водородными связями. После этого гидроксилирование и гликозилирование про-α-цепей прекращается.
5). Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
6). В межклеточном матриксе от некоторых проколлагенов(I, II, III, V, XI типов)проколлагенпептидазыотщепляют концевые С- иN-пропептиды, в результате чего образуетсятропоколлагены. У проколлагенов IV, VIII, X типов концевые пропептиды не отщепляются.
Синтезированные молекулы проколлагенов и тропоколлагенов способны образовывать различные структуры. Например, тропоколлагены образуют фибриллы, а проколлагены образуют сети.
| Структура | Тип коллагена |
| Фибриллы | I, II, III – основные. V, XI - минорные |
| Ассоциированные с фибриллами | IX, XII, XIV, XVI, XIX |
| Сети | IV, VIII, X |
| Микрофибриллы | VI |
| «Заякоренные» фибриллы | VII |
| Трансмембранные домены | XIII, XVII |
| Другие | XV, XVIII |
studfiles.net
| Тип | Локализация |
| I | Кожа, кости, сухожилия, суставы, фасции, связки, дентин |
| II | Хрящевая ткань, связочный аппарат |
| III | Кожа, стенки сосудов, пищеварительного тракта, эмбриональные ткани |
| IV | Базальные мембраны |
| V | Хрящевая и мышечная ткани |
| VI | Повсеместно |
| VII | Якорные фибриллы |
| VIII | Эндотелий сосудов |
| IX | Хрящевая ткань |
| XII | Хрящевая ткань |
| XIII | Повсеместно, включая эпидермис |
| XIV | Кожа, роговица, хрящевая ткань |
| XV | Повсеместно |
| XVII | Кожа, роговица, слизистые оболочки |
| XVIII | Эндотелий сосудов, роговица |
| XIX | Эпидермис |
Мутация в генах коллагена приводит к развитию различных болезней (несовершенного остеогенеза, синдромов Элерсо–Данло, ахондроплазии).
Коллагеновые волокна окружают многие клетки, обеспечивая их связи между собой или за счет наличия рецепторов в их мембранах, или через белки-посредники (Табл. 1.2).
Второй вид волокон – эластические, присутствуют в эластическом хряще, коже, легких, сосудах, включают эластин – гликопротеин с молекулярной массой 70 кД. Он, как и коллаген, содержит много глицина и пролина. В создании эластических структур также принимают участие фибриллины, которые формируют микрофибриллярный каркас.
Таблица 1.2
| Тип коллагена | Связывающий белок | Тип клеток |
| I | Фибронектин | Различные |
| II | Хондронектин | Хондроциты |
| | Фибронектин | Ретикулярные клетки |
| IV | Ламинин | Эпителиальные клетки |
После синтеза и созревания белки упаковываются в секреторные гранулы, выделяемые во внеклеточную среду. Особая роль в посттрансляционной модификации принадлежит лизилоксидазе, с помощью которой путем окислительного дезаминирования ε-аминогруппы в остатках лизина между четырьмя отдельными цепями формируются поперечные связи, обусловливающие образование резиноподобных структур, способных после деформации восстановить исходную форму.
Последний вид волокон – ретикулиновые – тонкие нити, состоящие из коллагена III типа, связанного с гликопротеинами и протеогликанами. Компоненты этих волокон синтезируются ретикулиновыми клетками, разновидностями фибробластов.
Таким образом, коллагеновые волокна придают СТ прочность и позволяют растягиваться, а эластические волокна – возвращают ткань в исходное положение после ее растяжения.
Наиболее распространены фибробласты, которые синтезируют компоненты межклеточного вещества (коллаген, эластин, фибронектин, ГАГи, протеогликаны и др.), активные участники заживления ран, способны к пролиферации и миграции.
Особую роль в осуществлении защитной функции играют мобильные макрофаги, способные синтезировать более 60 биологически активных веществ. При фагоцитозе выделяется содержимое лизосом, включающие различные гидролазы, АФК (О2˙־, НО˙, Н2О2), обладающие высоким антибактериальным эффектом. В активированных макрофагах интенсивно осуществляется окисление арахидоновой кислоты с образованием простагландинов, лейкотриенов, тромбоксана. Кроме того, в этих клетках синтезируются ферменты, разрушающие внеклеточный матрикс: эластаз, коллагеназ, протеиназ, гиалуронидаз. Макрофаги участвуют в заживлении ран, захватывают из крови денатурированные белки, обломки клеток, состарившиеся эритроциты, пылевые частицы, запускают иммунные реакции, проявляют противоопухолевую активность.
Тучные клетки участвуют в воспалительных и аллергических реакциях, продуцируют БАВ: гистамин, гепарин, протеазы, кислые гидролазы, простагландины, лейкотриены и тромбоксаны; их содержание в различных органах подвержено значительным индивидуальным и возрастным колебаниям. Гепарин запасается исключительно тучными клетками, попадая в кровь, связывает антитромбин III, усиливая его антисвертывающую активность. Последний фактор имеет значение и вцелом для соединительнотканных структур. По мере их старения снижается тургор, формируются морщины и т.д. При этом регистрируется обеднение тканей ГАГами, а отсюда – водой с параллельным накоплением грубоволокнистых коллагеновых образований. По мнению отдельных исследователей, в соединительных тканях заложена программа старения организма.
Уникальность структуры и функций СТ создает условия для возникновения огромного числа ее аномалий. В настоящее время известно многообразие генетических дефектов, способных привести к появлению признаков повреждений мезенхимальных структур. Они могут происходить вследствие:
нарушений синтеза или сборки коллагена;
генеза аномального коллагена:
ускоренной деградации коллагена;
недостаточной прочности поперечных сшивок;
аналогичных аномалий в эластиновых волокнах;
разрушения тканей посредством аутоиммунных реакций.
В группу наследственных коллагенопатий включают синдромы Элерса–Данло, Марфана, Альпорта, несовершенный остеогенез.
studfiles.net
Коллаген — полиморфный белок, в настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. 95% всего коллагена в организме человека составляют коллагены I, II и III типов.
Гены коллагена называются по типам коллагена и записываются арабскими цифрами, например СОL1 — ген коллагена 1 типа, COL2 — ген коллагена II типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид α-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1, и α2-цепи коллагена I типа.
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе:
1. На полисомах ЭПР синтезируются полипептидные препро-α-цепи коллагена. Они содержит начиная с N-конца: 1). гидрофобный «сигнальный» пептид, содержащий около 100 АК; 2). N-концевой пропептид, содержащий около 100 АК, в том числе цистеин; 3). α-цепь коллагена 4). С-концевой пропептид, содержащий около 250 АК, в том числе цистеин. Концевые С- и N-пропептиды формируют глобулярные домены и необходимы для правильного формирования тройной спирали. «Сигнальный» пептид, обеспечивает поступление синтезируемой на рибосоме препро-α-цепи в полость ЭПР.
2. В полости ЭПР при отщеплении сигнального пептида препро-α-цепи коллагена превращаются в про-α-цепи.
3. Поступающие в полости ЭПР про-α-цепи коллагена подвергаются модификации.
а). Цистеины N-пропептидов образуют внутрицепочечные дисульфидные мостики, формируя на N-конце глобулярную структуру;
б). Пролины и лизины в Y-положении (гли-х-у) про-α-цепей гидроксилируются пролил-4-гидроксилазой и лизил-5-гидроксилазой в 4-гидроксипролины (Hyp) и 5-гидроксилизины (Hyl). Некоторые пролины в Х-положениях гидроксилируются в 3-гидроксипролины пролил-3-гидроксилазой. Оксигеназы (гидроксилазы), содержат Fe2+, находятся на мембране ЭПР. Для реакции необходимы а-КГ, О2 и витамин С:
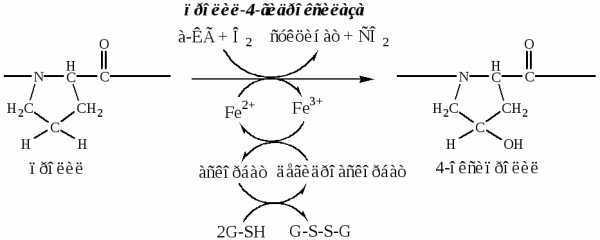
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина участвуют в образовании водородных связей.
Гидроксилирование лизина необходимо для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
в). Гидроксилизин про-α-цепей при участии гликозилтрансфераз гликозилируется галактозой или галактозилглюкозой. В молекуле коллагена сухожилий (тип I) количество углеводов равно 6, а в моллекуле коллагена капсулы хрусталика (тип TV) — 110. Роль этих углеводных групп неясна.
4). В просвете ЭПР после отделения от рибосом про-α-цепей, 3 из них с помощью С-концевых пропептидов соединяются между собой дисульфидными мостиками (цистеины С-пропептидов образуют внутри- и межцепочечные дисульфидные мостики) и скручиваются с образованием тройной спирали проколлагена. Тройная спираль проколлагена стабилизируется водородными связями. После этого гидроксилирование и гликозилирование про-α-цепей прекращается.
5). Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
6). В межклеточном матриксе от некоторых проколлагенов (I, II, III, V, XI типов) проколлагенпептидазы отщепляют концевые С- и N-пропептиды, в результате чего образуется тропоколлагены. У проколлагенов IV, VIII, X типов концевые пропептиды не отщепляются.
Синтезированные молекулы проколлагенов и тропоколлагенов способны образовывать различные структуры. Например, тропоколлагены образуют фибриллы, а проколлагены образуют сети и решетки.
| Структура | Тип коллагена |
| Фибриллы | I, II, III – основные. V, XI - минорные |
| Ассоциированные с фибриллами | IX, XII, XIV, XVI, XIX |
| Сети | IV, VIII, X |
| Микрофибриллы | VI |
| «Заякоренные» фибриллы | VII |
| Трансмембранные домены | XIII, XVII |
| Другие | XV, XVIII |
studfiles.net
Коллаген – это структурный белок, который обеспечивает прочность и эластичность соединительных тканей человеческого тела. Большая его часть поступает из потребляемой пищи. Но, в каких продуктах он находится? Существуют ли побочные эффекты и противопоказания для использования коллагена?
Коллаген представляет собой семейство белков, наиболее распространенных в животном мире, которые обеспечивают прочность и эластичность соединительных тканей, в частности, кожи, костей, хрящей и сухожилий.
Это семейство белков включает в себя целых двадцать восемь соединений, которые, хотя и отличаются по структуре, объединяет использование в структура, в основном, 5 аминокислот, а именно: глицин (35%), аланин (11%), лизин, пролин и гидроксипролин (21%).
Наиболее распространенная форма эндогенного коллагена, то есть образующегося в нашем организме, – это фибриллярный коллаген.
Экзогенный коллаген может быть классифицирован в зависимости от происхождения (животного или растительного) или структуры.
С учетом этих критериев, давайте рассмотрим различные типы в таблице ниже.
Коллаген животного происхождения Это коллаген, содержащийся в коже или хрящах различных животных, в частности:
|
Растительный коллаген Здесь мы подразумеваем белок, содержащийся в клеточных стенках сои, пшеницы, акации и водорослей, который часто называется «растительный коллаген» из-за высокого содержания гидроксипролина. |
Растворимый коллаген Это тропоколлаген, получаемый из кожи крупного рогатого скота и свиней; используется как увлажнитель кожи, как гиалуроновая кислота. |
Гидролизованный коллаген Получается из морского коллагена или суставов птицы. В смеси с пептидами легко усваивается организмом человека. Благодаря этой его особенности, гидролизованный коллаген входит в состав многих пищевых добавок. |
Хотя коллаген естественным образом производится в нашем организме, с течением времени или особых патологий его синтез может нарушаться: в результате происходит прогрессирующее снижение содержания коллагена, что нарушает структуру и функции соединительных тканей.
Для того, чтобы предотвратить или уменьшить масштабы этих потерь может потребоваться введение коллагена извне.
Его можно найти:
Для увеличения содержания коллагена в организме, следует обратить внимание на употребление двух видов продуктов, а именно:
В следующей таблице приведены некоторые продукты, которые могут увеличить образование коллагена в организме!
Источники глицина:
| Источники гидроксипролина:
|
Источники пролина:
| Источники лизина:
|
Источники витамина C:
|
Источники меди:
|
Источники марганца:
|
Пищевые добавки, как и продукты, имеют целью обеспечить поступление аминокислот, полезных для синтеза эндогенного коллагена, с той разницей, что в добавках количество аминокислот (прежде всего, пролина и гидроксипролина), безусловно, выше.
В частности, эти добавки содержат гидролизованный коллаген (морского происхождения или с птицефабрик), который усваивается наиболее быстро, особенно в сочетании с пептидами.
В эту группу входят кремы и сыворотки, используемые в ежедневном уходе для кожи, ногтей и волос. Как правило, эти продукты содержат растворимый коллаген, обладающий поверхностным увлажняющим действием, но не способный преодолеть эпидермальный барьер.
Одновременное употребление пищевых добавок и косметических средств с коллагеном способствует:
Коллагенновые наполнители вводятся в дерму путём инъекции. После укола наносится обезболивающий крем. Такая процедура не только на полняет кожу коллагеном, но и способна стимулировать синтез эндогенного коллагена и гиалуроновой кислоты.
Благодаря этим эффектам, коллагенновые наполнители полезны против:
Гидролизованный коллаген (морской или из птицы) может быть с успехом использован в следующих случаях:
Из данных, приведенных в медицинской литературе, следует, что продукты на основе коллагена хорошо переносятся человеком, даже при использовании в течение длительного времени, хотя могут появляться аллергические реакции у предрасположенных лиц.
Больший риск представляют коллагенновые наполнители, которые могут привести к:
Поэтому наполнители на основе коллагена крупного рогатого скота противопоказаны в следующих случаях:
Все сведения, приведенные приведены исключительно в ознакомительных целях. В случае каких-либо сомнений проконсультируйтесь с врачом или другим специалистом по здоровью, который направит Вас.
vseznam.ru
Коллаген — полиморфный белок, в настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. 95% всего коллагена в организме человека составляют коллагены I, II и III типов.
Гены коллагена называются по типам коллагена и записываются арабскими цифрами, например СОL1 — ген коллагена 1 типа, COL2 — ген коллагена II типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид α-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1, и α2-цепи коллагена I типа.
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе:
1. На полисомах ЭПР синтезируются полипептидные препро-α-цепиколлагена. Они содержит начиная сN-конца: 1). гидрофобный «сигнальный» пептид, содержащий около 100 АК; 2). N-концевой пропептид, содержащий около 100 АК, в том числе цистеин; 3). α-цепь коллагена 4). С-концевой пропептид, содержащий около 250 АК, в том числе цистеин. КонцевыеС- и N-пропептидыформируют глобулярные домены и необходимы для правильного формирования тройной спирали.«Сигнальный» пептид, обеспечивает поступление синтезируемой на рибосоме препро-α-цепи в полость ЭПР.
2. В полости ЭПР при отщеплении сигнального пептида препро-α-цепиколлагена превращаются впро-α-цепи.
3. Поступающие в полости ЭПР про-α-цепи коллагенаподвергаются модификации.
а). Цистеины N-пропептидов образуют внутрицепочечные дисульфидные мостики, формируя наN-конце глобулярную структуру;
б). Пролины и лизины в Y-положении (гли-х-у) про-α-цепей гидроксилируются пролил-4-гидроксилазойилизил-5-гидроксилазойв 4-гидроксипролины (Hyp) и 5-гидроксилизины (Hyl). Некоторые пролины в Х-положениях гидроксилируются в 3-гидроксипролины пролил-3-гидроксилазой. Оксигеназы (гидроксилазы), содержат Fe2+, находятся на мембране ЭПР. Для реакции необходимы а-КГ, О2и витамин С:
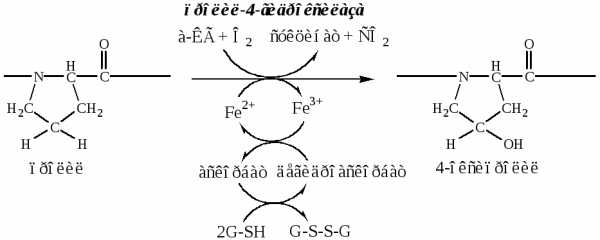
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина участвуют в образовании водородных связей.
Гидроксилирование лизина необходимо для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
в). Гидроксилизин про-α-цепей при участии гликозилтрансфераз гликозилируется галактозой или галактозилглюкозой. В молекуле коллагена сухожилий (тип I) количество углеводов равно 6, а в моллекуле коллагена капсулы хрусталика (тип TV) — 110. Роль этих углеводных групп неясна.
4). В просвете ЭПР после отделения от рибосом про-α-цепей, 3 из них с помощью С-концевых пропептидов соединяются между собой дисульфидными мостиками (цистеины С-пропептидов образуют внутри- и межцепочечные дисульфидные мостики) и скручиваются с образованием тройной спирали проколлагена. Тройная спираль проколлагена стабилизируется водородными связями. После этого гидроксилирование и гликозилирование про-α-цепей прекращается.
5). Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
6). В межклеточном матриксе от некоторых проколлагенов(I, II, III, V, XI типов)проколлагенпептидазыотщепляют концевые С- иN-пропептиды, в результате чего образуетсятропоколлагены. У проколлагенов IV, VIII, X типов концевые пропептиды не отщепляются.
Синтезированные молекулы проколлагенов и тропоколлагенов способны образовывать различные структуры. Например, тропоколлагены образуют фибриллы, а проколлагены образуют сети и решетки.
| Структура | Тип коллагена |
| Фибриллы | I, II, III – основные. V, XI - минорные |
| Ассоциированные с фибриллами | IX, XII, XIV, XVI, XIX |
| Сети | IV, VIII, X |
| Микрофибриллы | VI |
| «Заякоренные» фибриллы | VII |
| Трансмембранные домены | XIII, XVII |
| Другие | XV, XVIII |
studfiles.net
Время, современный ритм жизни и плохая экология, к сожалению, приводит к нежелательным и преждевременным морщинам и ослабевающей коже. Можно возложить ответственность за это на генетику; если Ваши родители страдали от морщин в раннем возрасте, скорее всего, у вас они тоже появятся рано. Вы также можете обвинить в этом все долгие дни отдыха, проведенные на солнце, или невезение и стресс. Независимо от того, в чем причина, морщины будут неприятными и не желательными. Хорошая новость состоит в том, что есть возможность замедлить признаки старения естественными, не жесткими методами.
С возрастом производство коллагена начинает замедляться, клеточные структуры теряют свою силу и начинают появляться морщины. В результате, кожа становится хрупкой и менее эластичной. Кроме того, волосы начинают терять цвет, суставы теряют свою гибкость, и качество костной ткани начинает ухудшаться. Частично это связано с потерей и разрушением коллагена в кожном слое. Коллаген существует в природе вашей кожи в виде структурной поддержки.
Коллаген представляет собой белок, состоящий из аминокислот, который находится в организме человека. Как и все белки, коллаген состоит из аминокислот, органических молекул, состоящих из углерода, водорода и кислорода. Коллаген, на самом деле, представляет собой семейство белков, а не одного конкретного белка, плюс, это сложная молекула, так что вы не увидите его простую химическую структуру. Обычно вы увидите схемы, показывающие коллаген в качестве волокна. Это наиболее распространенный белок в организме человека и других млекопитающих, составляющий 25% — 35% от общего содержания белка тела. Фибробласты — клетки, которые обычно производят коллаген.
Коллаген — главный нерастворимый волокнистый белок во внеклеточной матрице и в соединительной ткани. Коллаген образует фибриллы, которые обеспечивают структуру для фиброзной ткани, такие как сухожилия, связки и кожу. Коллаген также находится в хрящах, костях, кровеносных сосудах, роговице глаз, межпозвоночных дисках, мышцах, и в желудочно-кишечном тракте.
Фактически, это — единственный самый богатый белок в животном мире. Существует, по крайней мере, 28 типов коллагена, но 80 – 90 % коллагена в теле состоят из типов I, II, и III. Эти молекулы коллагена соединяются вместе, чтобы сформировать длинные тонкие волоконца, фибриллы, которые схожи по структуре. Тип IV, напротив, формирует двумерную сеточку. Несколько других типов связываются с коллагенами типа фибрилл, соединяя их вместе или с другими матричными компонентами. Когда-то считалось, что коллаген образуется фибробластами в соединительной ткани, но теперь известно, что многочисленные эпителиальные клетки также создают определенные типы коллагенов. Различные коллагены и структуры, их формирующие, служат одинаковой цели — помочь тканям выдерживать растяжение.
Коллаген Типа I находится по всему телу за исключением хрящевых тканей. Он находится в коже, сухожилиях,в сосудистой системе, связках, органах и является основным компонентом костей. Кроме того, синтезируется в ответ на повреждение волокнистых узелков. Более 90% коллагена в организме состоит из Типа I.
Коллаген Типа II является основным компонентом хряща. Он также находится в роговице и стекловидном теле глаз. Тип II сформирован из двух или более коллагенов или сополимеров, а не одного типа коллагена.
Тип III коллаген находится в стенках артерий и других полых органов и, как правило, встречается с фибриллой коллагена Типа I.
Тип IV формирует основы клеток базальной мембраны (белковых волокон и гликозаминогликанов, отделяющих эпителий от подлежащей ткани).
Коллаген Типа V и Типа XI незначительные компоненты ткани и встречаются в виде волокон вместе с Типом I и Типом II соответственно. Тип V формирует клеточные поверхности, волосы и плаценту.
1) Гидролизованный коллаген
Гидролизованный коллаген это вещество, вырабатываемое за счет разрушения коллагена, полученного из костей животных и/или соединительной ткани. Коллаген разбивается с помощью процесса, называемого гидролиз, который приводит к разбиению соединений посредством реакции с молекулами воды. Многие коллагеновые добавки или косметические товары на основе коллагена содержат гидролизованный коллаген.
2) Инъекции коллагена
Называемый «наполнителем», этот тип косметической процедуры предполагает введение определенных веществ, чтобы уменьшить признаки старения кожи (например, тонких линий). Наполнители Поли-L-молочной кислоты (Poly-L-lactic acid), например, помогают бороться с последствиями старения, стимулируя выработку коллагена в коже.
По данным исследований, инъекции с «кожным наполнителем» с содержанием гиалуроновой кислоты, также стимулирует выработку коллагена, восстанавливая структуру поврежденной кожи.
Хотя наполнители, как правило, считаются безопасными, они иногда приводят к побочным эффектам, таким как обесцвечивание кожи и к аллергическим реакциям. Более того, анти-aging эффект этих процедур, к сожалению, требует повторного лечения для поддержания результатов.
Даже если ваш организм не может производить тот же самый уровень коллагена, как и раньше, стимулирование выработки коллагена обладает потенциалом обратить вспять некоторые признаки старения. Прием препаратов, содержащих коллаген, поможет так же, как при приеме кальция, для поддержки крепких костей.
Препараты, содержащие коллаген, выпускаются в таблетках и жидком виде, и так как коллаген находится в вашей коже, костях и хрящах, вы можете сочетать его с другими добавками. Коллагеновые добавки можно сочетать с глюкозамином или хондроитином, двумя добавками, которые используются для лечения артрита и других проблем с суставами.
Поскольку коллаген дает хрящам силу, он также может быть полезным для тех, кто страдает от остеоартрита. Тем не менее, если у вас нет проблем с суставами, вы можете сделать выбор в пользу гидролизата коллагена или пептида коллагена. При приеме препаратов с коллагеном вы должны также увеличить потребление витамина C, так как витамин С помогает организму вырабатывать коллаген.
Ученые обнаружили, что коллаген способен переходить из твердой формы в более гибкое состояние, и обратно. Эти результаты позволили ученым разработать лекарства, которые могут снизить риск сердечного приступа, а именно, в случае, когда холестерин накапливается в артериях, коллаген образует защитный слой вокруг него, предотвращая от разрыва в артериальных бляшках.
Как и в любом лечении, получение результата после приема коллагена будет варьироваться от человека к человеку. Если вы не уверены, что прием таких препаратов подходит вам, проконсультируйтесь с врачом.
Некоторые сторонники утверждают, что коллагеновые добавки имеют широкий спектр преимуществ, в том числе:
Возможно, вам часто встречалась реклама об увлажняющих кремах против старения и морщин, которые стимулируют производство коллагена. Ключ к выбору правильного продукта — изучение того, что входит в состав подобных кремов. Если Вы ищете anti-aging увлажняющий крем для восстановления коллагена вашей кожи, следует обратить внимание на наличие следующих ключевых ингредиентов:
Коллагеновые крема могут помочь улучшить упругость и текстуру кожи в ближайшей перспективе, но общая цель состоит в том, чтобы стимулировать способность вашего организма увеличить производство коллагена. В то время как крема могут придать вашей коже здоровый блеск, однако, нет никакой гарантии, что вы будете выглядеть как в 20 лет.
Треонин является незаменимой аминокислотой для производства коллагена. Наше тело не производит эту аминокислоту, поэтому вы должны получить его из продуктов или пищевых добавок. Вы можете получить треонин из таких продуктов, как чечевица, арахис, яйца, молоко, свинина, говядина и курица. Если вы предпочитаете вегетарианскую диету, вы также можете получить треонин из соевых бобов, нута, хумуса, стручковой фасоли и спаржи.
Другая аминокислота, которая помогает в производстве коллагена — пролин. В отличие от треонина, пролин является заменимой аминокислотой; заменимые аминокислоты те, которые производит организм или другие незаменимые аминокислоты. Вы также можете помочь своему организму, употребляя продукты с высоким содержанием пролина, такие как желатин, соя, молоко, сыр, говядина и капуста. И как уже ранее упоминалось, витамин C работает вместе с пролином, содействуя выработки коллагена.
Вот такой большой ассортимент форм, дозировок и производителей коллагена:
1. Купить коллаген по низкой цене и с гарантированным высоким качеством можно в известном американском интернет-магазине органики iHerb, так полюбившемуся жителям России и СНГ (покупка в рублях, гривнах и т.д., отзывы на русском языке к каждой добавке).2. Подробная инструкция по оформлению заказа: Как сделать заказ на iHerb!3. При первом заказе, используя код iHerb, вы сэкономите 10 долларов! Рекомендуем обязательно воспользоваться, т.к. при втором заказе скидки уже не будет и даже кэшбэк-сайты не вернут проценты с покупки, т.к. цены совсем невысокие! Ещем рады предложить своим постоянным читателям промокод Остин на покупку одежды для всей семьи со скидкой, купон JD на приобретение товаров напрямую из Китая, промокод Юлмарт на 100 000 товаров со скидками, а также промокод 003 на скидку в недорогом интернет-магазине техники.4. Все об оплате и доставке: iHerb оплата и iHerb доставка!
Источник фото: iHerb.com
Помогает ли Вам коллаген? Как Вы его применяете?
Ниже вы можете прочитать реальные отзывы о коллагене. Какого типа коллаген для чего лучше подходит. Продукция какого производителя выгоднее по цене и эффективнее в применении!
herbhelp.ru
КОЛЛАГЕН (греч, kolla клей + gennao производить) — один из основных фибриллярных белков соединительной ткани, относящийся к группе склеропротеидов. Большая часть К. обнаруживается в составе коллагеновых волокон. К. является главным структурным компонентом коллагенового волокна, основная функция к-рого связана с формированием и поддержанием специфической структуры органов и тканей в процессе роста и развития организма. Стабилизирующая, опорная функция коллагенового волокна обеспечивается за счет его необычных биол, и физ.-хим. свойств (метаболическая инертность, устойчивость к действию различных веществ и т. д.), которые оно приобретает в результате упорядоченной агрегации молекул К. Патол, изменения обмена и структуры К. у человека возникают, как правило, при системных заболеваниях соединительной ткани (ревматизм, склеродермия и др.). В конечном счете все обнаруживаемые при той или иной патологии изменения биосинтеза или распада коллагеновых белков приводят к нарушению механических свойств коллагенового волокна и, следовательно, опорных свойств соединительной ткани.
К. и продукт его денатурации — желатина (см.) представляют значительный интерес в связи с применением этого белка для изготовления сосудистых протезов и пленок для лечения ран, а также в связи с использованием в некоторых отраслях промышленности (пищевой, легкой, кино- и фотопроизводстве).
К. чрезвычайно широко распространен в различных органах и тканях позвоночных и беспозвоночных животных; не содержат его только простейшие и бактерии.
По аминокислотному составу К. резко отличается от большинства белков (см.). Основными особенностями аминокислотного состава К., полученного из любого источника, являются высокое содержание глицина, низкое содержание серосодержащих аминокислот, отсутствие триптофана, наличие оксилизина и оксипролина. К. является гликопротеидом, содержание углеводов в к-ром может варьировать в зависимости от источника получения белка. Молекула К. беспозвоночных животных, как правило, содержит больше углеводов, чем молекула К. позвоночных. Большая часть углеводов в К. позвоночных идентифицирована как D-галактоза и D-глюкоза.
К. является единственным из всех известных белков, полипептидные цепи (альфа-цепи) к-рого почти на всем протяжении построены из повторяющихся триплетов гли-X-Y, в которых положение X и Y могут занимать любые, кроме глициновых, остатки аминокислот. Стержневидная молекула К., получившая в ранних исследованиях название тропоколлагена (элементарная структурная единица коллагенового волокна), имеет мол. вес (массу) ок. 300 000, длину ок. 300 нм и толщину ок. 1,5 нм. Она состоит из трех полипептидных цепей, представляющих скрученные спирали, «навинченные» как бы на один общий цилиндр. Каждая a-цепь (мол. вес ок. 100 000) имеет спиральную структуру, сходную со структурой поли-L-пролина. Спирали содержат 3 аминокислотных остатка на один виток с одной или двумя водородными связями на триплет. На N-и C-концевых участках альфа-цепей молекулы К. имеются неспиральные области (тело-пептиды), не содержащие регулярно повторяющихся аминокислотных триплетов.
В зависимости от хим. строения альфа-цепей, входящих в состав коллагеновой молекулы, различают 4 типа К.: I тип содержит в своей молекуле две альфа1(I)-цепи и одну альфа2-цепь, II тип — три альфа1(II)-цепи, III тип — три альфа1(III)-цепи и IV тип — три альфа1(IV)цепи. Каждый тип соединительной ткани характеризуется, в свою очередь, и наличием К. определенного типа: в коже и костной ткани обнаруживается в основном коллаген типа I, в хрящевой ткани — типа II, в базальных мембранах — типа IV и т. д. Молекулярная гетерогенность коллагеновых белков может выявляться также и в пределах одного типа соединительной ткани.
Стабилизация структуры молекулы К. и коллагенового волокна осуществляется за счет нековалентных и ковалентных поперечных связей. К числу нековалентных стабилизирующих связей относятся электростатические, гидрофобные и водородные. Водородные связи типа —CO...HN— образуются между карбонильным кислородом и NH-группой пептидной связи между цепями, а водородные связи типа —OH....OC— возникают при взаимодействии карбонильного кислорода с OH-группой остатков оксипролина. Стабилизация структуры К. поперечными ковалентными связями осуществляется гл. обр. при участии альдегидных группировок, образующихся в результате ферментативного окислительного дезаминирования ε-Nh3-групп определенных остатков лизина и оксилизина. Альдегидные группировки двух соседних a-цепей, взаимодействуя между собой, образуют поперечные ковалентные связи альдольного типа. При взаимодействии альдегидной группировки одной альфа-цепи с ε-Nh3-группой остатков лизина или оксилизина другой альфа-цепи возникают поперечные альдиминные связи — Шиффа основания (см.).
При денатурации К., ведущей к образованию желатины в мягких условиях (умеренное прогревание, действие мочевины и т. д.), разрываются только нековалентные связи. В этом случае молекула К. распадается на отдельные альфа-цепи, их димеры (бета-компоненты) или тримеры (гамма-компоненты). Гидролиз пептидных и других ковалентных связей происходит только при жесткой обработке К., применяемой при получении пищевых и промышленных препаратов желатины и приводящей к образованию продуктов, не способных к ренатурации (см. Денатурация).
Синтез К. является функцией клеток мезенхимального происхождения, которые в зависимости от типа соединительной ткани получили названия фибробластов, хондробластов, остеобластов и т. д. В определенных условиях клетки эктодермального происхождения также могут синтезировать К. Как и большинство других белков, секретируемых во внеклеточное пространство, К. синтезируется в клетке на полисомах, связанных с мембранами эндоплазматического ретикулума, в виде предшественника-— проколлагена (ранее термин «проколлаген» широко использовался для обозначения растворимых фракций К., экстрагируемых из ткани солевыми р-рами при различных значениях pH).
Альфа-Цепи проколлагена (про-альфа-цепи) имеют несколько больший мол. вес, чем альфа-цепи коллагена (120 000—140 000), и содержат, помимо телопептидов, на N- и С-конце дополнительные полипептиды, резко отличающиеся по аминокислотному составу от спиральных участков коллагеновой молекулы. В процессе выведения из клетки или во внеклеточном пространстве вновь синтезированные молекулы проколлагена превращаются в К., при этом от проколлагена ферментативно отщепляются дополнительные N- и С-концевые полипептиды, содержащие дисульфидные (—S—S—) связи. Функц, значение отщепляемых от проколлагена полипептидов заключается в том, что они облегчают образование тройкой спирали в коллагеновых молекулах Pi в то же время предотвращают их агрегацию внутри клетки.
Синтез функционально полноценных молекул К., т. е. молекул, способных к агрегации, происходит только при наличии в клетке специальных систем, осуществляющих пост-трансляционную модификацию альфа-цепей К.: гидроксилирование пролиновых и лизиновых остатков и гликозилирование оксилизиновых остатков. Реакция гидроксилирования пролиновых и лизиновых остатков про-альфа-цепей катализируется различными ферментами (пролил- и лизилгидроксилазами), связанными с мембранами эндоплазматического ретикулума, но в основе этой реакции лежит один и тот же механизм. Трансляция a-цепей проколлагена происходит и при блокировании реакции гидроксилирования, но в этом случае образующийся негидроксилированный проколлаген (протоколлаген, протопроколлаген) не секретируется из клетки. После окончания трансляции a-цепей входящие в состав К. галактоза и глюкоза связываются с OH-группой одного из остатков оксилизина в виде дисахарида (глюкозил-галактоза). Этот процесс также происходит при участии связанных с мембранами ферментов — коллагеновых галактозил- и глюкозилтрансфераз.
В распаде коллагеновых белков в организме главную роль играет специальный фермент — коллагеназа, расщепляющая молекулу К. на два фрагмента, составляющих 3/4 и 1/4 от ее длины. В результате понижается стабильность структуры К. и облегчается его расщепление другими протеолитическими ферментами (кислыми и нейтральными протеазами лизосомного происхождения), которые не действуют на нативный К.
Электронная микрофотография нативных коллагеновых волокон: отчетливо видна характерная поперечная исчерченность волокон; х 40 000.В световом микроскопе коллагеновые волокна обнаруживаются в виде структур из параллельно расположенных фибриллярных элементов, обладающих двойным лучепреломлением. Средний диаметр коллагенового волокна может варьировать в зависимости от типа соединительной ткани и ее функц, состояния. Поперечная исчерченность является одним из характерных признаков коллагенового волокна; эта исчерченность обнаруживается на электронно-микроскопических снимках в виде чередующихся темных и светлых полос (рис.). Комбинация темной и светлой полосы составляет в волокне один основной период, размер к-рого, равный в среднем 64— 70 нм, может варьировать в зависимости от способа обработки и степени натяжения волокна. В пределах одного основного периода в коллагеновых волокнах выявляются в определенных условиях дополнительные темные полосы, число которых в зависимости от способа подготовки волокна для электронной микроскопии колеблется от 4 до 16. Поперечная исчерченность коллагенового волокна объясняется различной «упаковкой» отдельных участков молекул К., что обусловлено, в свою очередь, неравномерным распределением аминокислотных остатков. В тех участках, где преобладают полярные аминокислотные остатки (аргинин, лизин, аспарагиновая и глутаминовая к-ты и т. д.), «упаковка» менее упорядочена; она соответствует темным полосам. Строго упорядоченная упаковка, присущая светлым полосам, обусловлена концентрированием в этих участках аполярных аминокислотных остатков (пролин, оксиаминокислоты и т. д.). Специфическое распределение аполярных и полярных аминокислотных остатков при формировании коллагенового волокна осуществляется за счет бокового взаимодействия молекул К. и их смещения в отношении друг друга в процессе агрегации на 0,4 длины основного периода.
Скорость образования коллагенового волокна in vivo или in vitro в большой степени зависит от величины pH, температуры и присутствия в окружающей среде тех или иных, веществ, ускоряющих или замедляющих этот процесс (АТФ, гликозаминогликаны, мочевина, аскорбиновая к-та, катехоламины и т. д.). При этом в зависимости от условий могут образовываться не только волокна обычного типа с периодом 64 нм, но и другие фибриллярные структуры, напр, агрегаты с периодом поперечной исчерченности 200—300 нм (фибриллярные или сегментарные структуры с большими периодами).
Процессы биосинтеза, распада К. и фибриллогенеза могут протекать с различной скоростью в зависимости от типа соединительной ткани, а также изменяться при ряде физиол, и патол, состояний организма (возраст, регенерация, воспаление, коллагеновые болезни, авитаминозы, гормональные нарушения и т. д.). Как правило, биосинтез К. и образование коллагеновых волокон значительно усиливаются при различных процессах, сопровождающихся разрастанием соединительной ткани (склеротические изменения сосудов и органов, хрон, воспалительные изменения, заживление ран и переломов костей и др.)* Иногда эти процессы могут быть обратимыми и сопровождаться резким усилением распада К. Примером этого может служить быстрое снижение содержания К. в матке после окончания беременности, удаление коллагеновых структур в процессе метаморфоза некоторых организмов, резорбция костной ткани при переломах и т. п.
См. также Склеропротеиды.
При патол, процессах в соединительной ткани (см.) изменяются основные ее элементы— коллагеновые волокна. Чаще всего эти изменения являются результатом воспалительных реакций, при которых происходят разнообразные превращения как бесструктурного основного вещества, так и К.
При любом воспалительном процессе коллагеновые волокна набухают, затем происходит их фрагментарный распад и растворение под действием протеолитических ферментов полиморфно-ядерных лейкоцитов и фагоцитов. В процессе распада коллагеновые волокна утрачивают присущие им тинкториальные свойства и перестают окрашиваться в гистол. срезах специфическими для них красителями, напр, кислым фуксином.
При коллагеновых болезнях (см.) сначала наступает отек и набухание коллагеновых волокон, а затем их фибриноидное пропитывание (см. Фибриноидное превращение) и некроз (см.). Эти изменения К. и последующие гранулематозные реакции составляют основу всех патол, процессов, протекающих с преимущественным поражением соединительной ткани: дерматомиозита (см.), ревматизма (см.), ревматоидного артрита (см.), острой красной волчанки (см.) и др.
Патол, проявления наблюдаются также при недостаточном или избыточном образовании коллагеновых волокон. Напр., образование келоидных рубцов (см. Келоид) происходит за счет избыточного синтеза К. фибробластами.
Недостаточный коллагеногенез характерен для ряда патол, процессов и синдромов, описанных под названиями десмогенез несовершенный (см.), остеогенез несовершенный (см.) и хондрогенез несовершенный (см.). Сюда же относится и синдром Марфана (см. Марфана синдром). Для всех этих заболеваний характерна врожденная неполноценность коллагенового каркаса кожи, костей, сосудов, вследствие чего резко снижается их механическая прочность.
Причины гипо- и гиперколлагеногенеза остаются неясными. При врожденных заболеваниях речь, очевидно, идет о генетических дефектах. Полнее изучены процессы коллагенообразования при раневом процессе. В частности, установлено, что АКТГ и глюкокортикоиды вызывают раннюю дифференциацию и созревание фибробластов, что сопровождается нарушением коллагеногенеза, недостаточным образованием грануляций и их ранним созреванием с формированием слабого рубца. Минералокортикоидные гормоны, соматотропный гормон, тироксин, тиреокальцитонин, напротив, стимулируют коллагеногенез настолько, что образуется грубый рубец.
Недостаточность витамина С угнетает пролиферацию фибробластов и подавляет синтез К. Некоторые исследователи полагают, что при этом нарушается «сборка» молекул К. вследствие угнетения ферментативного гидроксилирования. Гипоколлагеногенез наблюдается также при лучевой болезни, когда вследствие недостаточной дифференциации фибробластов образуются тонкие, непрочные или, напротив, грубые, утолщенные коллагеновые волокна.
Библиография: Мазуров В. И. Биохимия коллагеновых белков, М., 1974, библиогр.; С л у ц к и й Л. И. Биохимия нормальной и патологически^ измененной соединительной ткани, Л., 1969, библиогр.; Biochemistry of collagen, ed. by G. N. Rama-chandran a. A. H. Reddi, N. Y., 1976; B o r n s t e i n P. The biosynthesis of collagen, Ann. Rev. Biochem., v. 43, p. 567, » 1974; G a 1 1 o p P. M. a. P a z М. А. Posttranslational protein modifications, with special attention to collagen and elas-tin, Physiol. Rev., v. 55, p. 418, 1975; Martin G.R., ByersP. H. a. Piez K. A. Procollagen, Advanc. Enzymol., v. 42, p. 167, 1975, bibliogr.
В. И. Мазуров; Пермяков (пат. ан.).
xn--90aw5c.xn--c1avg